Первый шаг в конструировании рекомбинантного бакуловируса AcMNPV состоит в создании транспортного вектора. Транспортный вектор - это производная плазмиды E. coli, содержащая фрагмент ДНК AcMNPV (рис. 7.8). Кодирующая последовательность гена полиэдрина из этого фермента удалена.

|
| Рис. 7.8. Схематическое представление единицы экспрессии транспортного вектора на основе бакуловирусов (AcMNPV). Ген белка-мишени встраивают в сайт клонирования (СК) между промотором гена полиэдрина (Рр) и сайтом терминации его транскрипции (Pt). |
Культуру клеток насекомого, трансфицированную ДНК AcMNPV, трансфицируют затем транспортным вектором, несущим клонированный ген. В некоторых дважды трансфицированных клетках происходит двойной кроссинговер, в результате которого клонированный ген вместе с промотором и сигналом терминации транскрипции гена полиэдрина встраивается в ДНК AcMNPV (рис. 7.9), замещая ген полиэдрина. Вирионы, не содержащие этого гена, образуют зоны клеточного лизиса, из которых можно выделить рекомбинантный бакуловирус.

|
| Рис. 7.9. Замещение гена полиэдрина AcMNPV единице и экспрессии транспортного вектора в результате двойного кроссинговера в 5'- и 3 '-фрагментах. |
Визуальная идентификация зон лизиса — утомительная и субъективная процедура. Вместо нее для обнаружения рекомбинантных бакуловирусов можно использовать ДНК-гибридизацию или полимеразную цепную реакцию (ПЦР). Кроме того, если под контроль промотора бакуловируса, активного с ранних и до поздних стадии литического цикла, поместить ген lacZ E. coli., кодирующий ß-галактозидазу, и такую конструкцию включить во фрагмент ДНК, встраивающийся в геном AcMNPV, то в присутствии хромогенного субстрата ß-галактозидазы зоны с рекомбинантными вирусами окрасятся в синий цвет.
Гетерологичный белок, синтезируемый культурой клеток насекомого-хозяина, зараженной рекомбинантным бакуловирусом, можно выделять через 4—5 сут.
С помощью системы экспрессирующих векторов на основе бакуловирусов уже получено более 500 различных гетерологичных белков, при этом более 95% из них имели правильные посттрансляционные модификации.
16. Охарактеризуйте экспрессирующие векторы для работы с клетками млекопитающих.
Внехромосомные экспрессирующие векторы млекопитающих используются для изучения функций и регуляции генов млекопитающих. Кроме того, с их помощью могут быть получены аутентичные рекомбинантные белки, которые потенциально могут быть применимы в медицинских целях для лечения некоторых заболеваний человека. Уже сконструированные экспрессирующие векторы млекопитающих весьма многочисленны, но все они обладают сходными свойствами и похожи на другие эукариотические экспрессирующие векторы.
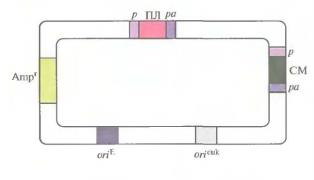 Полилинкер (ПЛ), представляющий собой множественный сайт клонирования, и селективный маркер (СМ) находятся под контролем эукариотического промотора (р) и сигнала полиаденилирования (ра) или терминации. Обычно используют регуляторные последовательности ДНК вирусов животных (например, цитомегаловируса человека, SV40 или HSV) или генов млекопитающих (гена β-актина, металлотионеина, тимидинкиназы или гена гормона роста). Репликация в клетках E.coli и в клетках млекопитающих обеспечивается соответствующими сайтами инициации репликации: ori плазмиды colEI и, например, обезьяньего вируса 40 (SV40). Для отбора трансформированных клеток E.coli используется ген устойчивости к ампициллину Amp.
Полилинкер (ПЛ), представляющий собой множественный сайт клонирования, и селективный маркер (СМ) находятся под контролем эукариотического промотора (р) и сигнала полиаденилирования (ра) или терминации. Обычно используют регуляторные последовательности ДНК вирусов животных (например, цитомегаловируса человека, SV40 или HSV) или генов млекопитающих (гена β-актина, металлотионеина, тимидинкиназы или гена гормона роста). Репликация в клетках E.coli и в клетках млекопитающих обеспечивается соответствующими сайтами инициации репликации: ori плазмиды colEI и, например, обезьяньего вируса 40 (SV40). Для отбора трансформированных клеток E.coli используется ген устойчивости к ампициллину Amp.
В качестве селективных маркеров для трансфицированных клеток млекопитающих используют разные гены:
1. Бактериальный ген Neo, кодирующий неомицинфосфотрансферазу, которая обеспечивает устойчивость трансфецированных клеток к токсичному соединению генетицин (G-418), блокирующее трансляцию в нетрансфицированных клетках млекопитающих.
2. Ген, кодирующий дигидрофолатредуктазу (ДГФР). В этой системе используют клетки с дефектом гена ДГФР, которые не способны расти на среде с метотрексатом. Отобранные клетки пересевают на среды с большей концентрацией метотрексата, отбирая, таким образом, более устойчивые клетки, т.е. содержащие больше копий вектора.
3. Ген фермента глутаминсинтетазы (GS), обеспечивающий устойчивость к цитотоксическому действию метионинсульфоксимина. Вектор, содержащий GS- ген,вводят в культуру клеток млекопитающих и для отбора клеток, несущих большое количество копий вектора, повышают концентрацию метионинсульфоксимина в среде. При этом в хозяйских клетках тоже должна присутствовать GS, поскольку только множественные копии GS-гена могут обеспечивать устойчивость к метионинсульфоксимину.
17. Опишите, какие задачи можно решать при помощи олигонуклеотид-направленного мутагенеза; объясните преимущества и недостатки использования ДНК фага М13, плазмидной ДНК, ПЦР-амплификации.
Олигонуклеотид-направленный (сайт-специфический) мутагенез — это один из наиболее простых методов внесения точковых мутаций в клонированный ген. Для его осуществления необходимо знать: 1) точную нуклеотидную последовательность той области ДНК, которая соответствует мРНК-кодону, подлежащему изменению; 2) характер аминокислотных замен.
Обычно встраивают ген-мишень в двухцепочечную форму вектора на основе бактериофага M13.

Сначала выделяют одноцепочечную форму вектора (плюс-цепь M13) и смешивают ее с синтетическим олигонуклеотидом, в точности комплементарным — за исключением одного нуклеотида -- нужному сегменту клонированного гена. Этот отличающийся (т. е. неспаривающийся) нуклеотид соответствует тому нуклеотиду кодона мРНК, который необходимо изменить.
Олигонуклеотид будет гибридизоваться с комплементарным участком клонированного гена в том случае, если: 1) он добавлен в количестве, во много раз превышающем количество ДНК М13; 2) неспаривающийся нуклеотид находится примерно посередине олигонуклеотида; 3) отжиг проводят при низкой температуре и высокой ионной силе. 3'-конец спарившегося олигонуклеотида служит затравкой для инициации синтеза ДНК, а интактная цепь ДНК M13 — матрицей. Репликация осуществляется с помощью фрагмента Кленова ДНК-полимеразы I Escherichiacoli при наличии в среде четырех дезоксирибонуклеозидтрифосфатов«а присоединение последнего нуклеотида синтезированной цепи к 5'-концу затравки обеспечивает ДНК-лигаза фага Т4. Однако in vitro синтез ДНК редко идет до конца, и частично двухцепочечные молекулы приходится отделять от нормальных центрифугированием в градиенте сахарозы.
Полностью двухцепочечными молекулами ДНКфага М13, содержащими, однако, некомплементарные нуклеотиды, трансформируют клетки Е. coll. В последних образуются фаговые частицы, что в конечном счете приводит к лизису клеток и образованию бляшек. Поскольку репликация идет по полуконсервативному механизму, половина популяции образующихся фаговых частиц должна содержать ДНК дикого типа, а половина — мутантную ДНК со специфической нуклеотидной заменой. Частицы, содержащие только мутантный ген, идентифицируют при помощи ДНК-гибридизации в жестких условиях, используя в качестве зонда исходный олигонуклеотид. Мутантный ген вырезают и встраивают в какой-либо экспрессирующий Е. соli -вектор. Мутантный белок синтезируют в E. coli и очищают.
 2020-01-14
2020-01-14 278
278








