Повышение эффективности секреции
Стабильность белков, кодируемых клонированными генами, зависит от их клеточной локализации. Например, рекомбинантный проинсулин оказывается примерно в 10 раз более стабильным, если он секретируется (экспортируется) в периплазму (пространство между плазматической и наружной мембранами), а не остается в цитоплазме. Кроме того, белки, секретируемые в периплазму или в среду, легче очистить. Обычно транспорт белков через клеточную мембрану обеспечивают N-концевые аминокислотные последовательности, называемые сигнальными пептидами (сигнальными последовательностями, лидерными пептидами). Иногда удается сделать белок секретеруемым, присоединив к кодирующему его гену нуклеотидную последовательность, ответственную за синтез сигнального пептида. Однако простое наличие сигнального пептида не обеспечивает эффективной секреции.
Кроме того, Е. coli и другие грамотрицательные микроорганизмы обычно не могут секретировать белки в окружающую среду из-за наличия наружной мембраны. Есть по крайней мере два способа решения этой проблемы. Первый — использование грамположительных про- или эукариот, лишенных наружной мембраны, второй — создание грамотрицательных бактерий, способных секретировать белки в среду, с помощью генной инженерии.
Если слияние гена-мишени с фрагментом ДНК, кодирующим сигнальный пептид, не приводит к эффективной секреции белкового продукта, приходится использовать другие стратегические приемы. Один из таких приемов, с успехом примененных в отношении интерлейкина-2, основывался на слиянии гена, кодирующего интерлейкин-2, с геном, кодирующим полноразмерный предшественник мальтозосвязывающего белка, а не только его сигнальную последовательность, и разделении этих генов сегментом ДНК, кодирующим сайт узнавания для фактора Ха. Когда такой химерный ген включили в плазмидный вектор и использовали его для трансформации Е. coli, в периплазме хозяйской клетки обнаружили в большом количестве химерный белок. Обработав его фактором Ха, получили функциональный интерлейкин-2.
Некоторые грамотрицательные бактерии секретируют в среду белок, называемый бактериоцином. Он активирует фосфолипазу А, локализо ванную во внутренней мембране бактериальной клетки, в результате чего и внутренняя, и наружная мембраны становятся проницаемыми, и не которые цито- и периплазматические белки высвобождаются в культуральную среду. Таким образом, можно встроить ген бактериоцина в плазмиду так, чтобы он находился под контролем сильного регулируемого промотора, трансформировать клетки Е. coli этой плазмидой и сделать их проницаемыми.
Когда секретируемые чужеродные белки образуются в Е. coli в слишком большом количестве, очень часто процессинг претерпевают не все белки-предшественники: примерно половина секретированных белков сохраняет лидерную последовательность, а другая половина полностью процессируется с образованием зрелой формы. Это может быть связано с недостатком каких-то белков, участвующих в секреции. В такой ситуации, чтобы увеличить долю процессированных белков, можно попытаться повысить уровень экспрессии генов, ответственных за синтез лимитирующих компонентов секретирующей системы. Для проверки сделали эксперимент… бла бла бла…
Грибы Aspergillus секретируют в среду большое количество ферментов и широко используются для их промышленного производства. В одной из работ осуществили слияние гена человеческого интерферона с геном сигнального пептида, ответственного за секрецию, и поместили эту конструкцию под контроль глюкоамилазного промотора Aspergillus nidulans, индуцируемого крахмалом После добавления последнего в среду с трансформированными клетками Aspergillus nidulans выход секретируемого человеческого интерферона достиг 1 мг на 1 л, что эквивалентно примерно 5% всего секретируемого клеточного белка. Эта работа показывает, что стратегии модулирования генной экспрессии, разработанные для Е. coli, можно использовать и применительно к другим биологическим системам.
13. Опишите систему экспрессии S. cerevisiae; укажите преимущества дрожжевых систем экспрессии S. cerevisiae для синтеза эукариотических белков.
Для экспрессии клонированных эукариотических генов интенсивно используют обычные дрожжи Saccharomyces cerevisiae. Тому есть несколько причин. Во-первых, это одноклеточный организм, генетика и физиология которого детально изучены и который можно выращивать как в небольших лабораторных колбах, так и в промышленных биореакторах. Во-вторых, вы-
делены и охарактеризованы несколько сильных промоторов этих дрожжей, а для систем эндогенных дрожжевых экспрессирующих векторов
могут использоваться природные, так называемые 2 мкм-плазмиды. Втретьих, в клетках 5. cerevisiae осуществляется большое число посттрансляционных модификаций. В-четвертых, лишь очень немногие из собственных дрожжевых белков секретируются в среду; таким образом, если гетерологичный белок секретируется клеткой, то его очистка не составит большого труда.Векторы для S. cerevisiae Существует три типа экспрессирующих векторов ддя S. cerevisiae. 1) эписомные, или плазмидные векторы; 2) интегрирующие векторы, 3) искусственные дрожжевые хромосомы (YAC). Плазмидные векторы уже широко использовались для получения как секретируемых, так и несекретируемых гетерологичных белков. Однако системы экспрессии, основанные на использовании плазмид, зачастую оказываются нестабильными при выращивании клеток в больших объемах (>10 л). Стратегия с использованием векторов второго типа пока не получила широкого распространения, несмотря на то что в результате интеграции экспрессирующего вектора или транскриптона в хромосомную ДНК получается стабильный рекомбинантный организм. Причиной этого служит то, что число копий клонированного гена ограничивается одной на хромосому, иными словами, конечный выход белка невысок. Можно было бы использовать тандемные последовательности генов, но они часто оказываются нестабильными. Поэтому исследователи остановились на плазмидных векторах с одним клонированным геном, но попытались изменить условия роста, с тем чтобы повысить стабильность плазмид. Искусственные дрожжевые хромосомы (YAC) предназначены для клонирования больших фрагментов ДНК (100 т. п. н.), которые затем поддер-
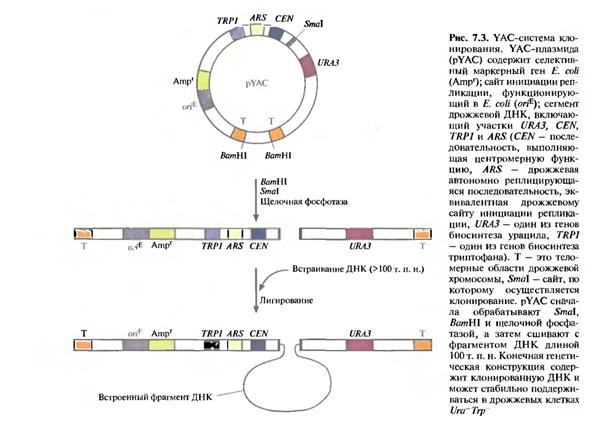
живаются в дрожжевой клетке как отдельные хромосомы. YAC-система чрезвычайно стабильна. С ее помощью проводили физическое картирование геномной ДНК человека и анализ больших транскриптонов, создавали геномные библиотеки, содержащие ДНК индивидуальных хромосом человека. YAC-вектор напоминает хромосому, поскольку он содержит последовательность, функционирующую как сайт инициации репликации ДНК (автономно реплицирующуюся последовательность), сегмент центромерной области дрожжевой хромосомы и последовательности, образующиеся на обоих концах при линеаризации ДНК и действующие как теломеры, обеспечивающие стабильность хромосомы (рис. 7.3). При встраивании чужеродной ДНК в YAC может происходить нарушение рамки считывания маркерного дрожжевого гена. В результате продукт этого гена не образуется, и при выращивании клеток на специальной среде можно наблюдать цветную реакцию. Кроме того, некоторые YAC-векторы несут селективный маркер, независимый от сайта клонирования. Несмотря на все преимущества, YAC пока не использовались для промышленного синтеза гетерологичных белков.
14. Опишите альтернативные дрожжевые системы экспрессии, кроме S. cerevisiae; укажите их преимущества. Объясните, почему для получения белков, использующихся в медицине, лучше применять эукариотические, а не прокариотические системы экспрессии.
С помощью систем экспрессии S. cerevisiae удалось получить много разных рекомбинантных белков. К сожалению, в большинстве случаев уровень их экспрессии был довольно низким. Кроме того, обнаружились и другие проблемы. При увеличении масштабов системы часто происходит потеря плазмид, даже если используются индуцируемые промоторы.
• Гетерологичный белок зачастую оказывается гипергликозилированным и содержит более 100 остатков маннозы в каждой боковой олигосахаридной цепи, в то время как в нативных белках их содержится только от 8 до 13 на цепь. Наличие лишних маннозных остатков может изменять биологическую активность продукта или его иммуногенность.
• Во многих экспериментах белки, которые должны были секретироваться, на самом деле концентрировались в периплазматиче-ском пространстве, что еще более осложняло их очистку. Все это заставило ученых исследовать возможность получения гетерологичных белков с помощью других видов дрожжей и с использованием эукариотических систем. В частности, изучались соответствующие векторы — системы экспрессии, содержащие видоспецифичные регуляторные последовательности транскрипции и трансляции, возможность трансформации этих видов и получения высокого выхода белков и возможность крупномасштабного культивирования организма-хозяина. В качестве альтернативы S. cerevisiae можно использовать Kluyveromyces lactis, дрожжи, которые применяют для промышленного производства лактозы.ф-галактозидазы; Schizosaccharomyces pombe, дрожжи, размножающиеся делением, а не почкованием; Yarrowia lipolytica, которые используют алканы в качестве субстрата; Pichia pastoris и Hansenula polymorpha, которые могут использовать метанол как единственный источник углерода и энергии. Синтез поверхностного антигена вируса гепатита В Метилотрофные дрожжи P. pastoris можно без труда и больших затрат выращивать в промышленных биореакторах. Их использование в качестве организма-хозяина позволило бы увеличить выход активных продуктов — гетерологичных белков. Такой вывод можно сделать, рассмотрев в качестве примера получение поверхностного антигена вируса гепатита В (HBsAg) с помощью специально разработанной системы с использованием интегрирующего вектора. Сначала ген HBsAg встроили между промотором гена алкогольоксидазы 1 (AOXlp) и сигналом терминации-полиаденилирования (AOXlt) того же гена (рис. 7.5). Регуляция активности гена АОХ1 Р. pastoris осуществляется с помощью метанола. В его присутствии на долю алкогольоксидазы может приходиться до 30% всех белков клетки, а в отсутствие метанола алкогольоксидаза не синтезируется вообще.

Вектор (рис. 7.5), специально сконструированный для этих исследований, содержал следующие элементы: 1) блок AOXlp-HBsAg-AOXIf, 2) сайт инициации репликации, функционирующий в P. pastoris', 3) фрагмент ДНК, содержащий сайт инициации репликации плазмиды pBR322 и селективный маркер Е. colt, 4) фрагмент У АОХ1, способствующий интеграции клонированной ДНК в определенный сайт хромосомы;
5) активный ген гистидинолдегидрогеназы (HIS4), кодирующий фермент, который участвует в синтезе аминокислоты гистидина. Наличие в этой конструкции последовательностей pBR322 позволяет использовать для работы с ней Е. coli, что облегчает клонирование и при необходимости позволяет получать большие ко-личества векторной ДНК. Чтобы предотвратить утрату плазмиды, была предусмотрена интеграция участка AOXlp-HBsAg-AOXlt в геном P. pastoris. Для этого штамм P. pastoris HIS4
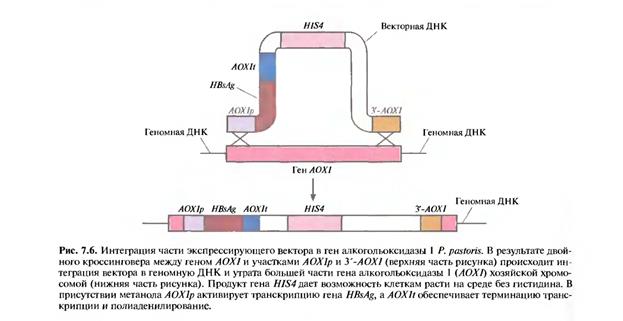
- с дефектным геном гистидинолдегидрогеназы трансформировали фрагментом вектора, содержащим элементы AOXlp-HBsAg-AOXIt, HIS4 и У-АОХ1 (рис. 7.5). В результате двойного кроссинговера между AOXlp и У-АОХ1 введенной ДНК, с одной сто-
роны, и комплементарными последовательностями хромосомной ДНК, с другой, произошла интеграция последовательностей AOXlp-HBsAg-AOXlt и HIS4 в геном, сопровождающаяся утра-той хромосомного гена АОХ1 (рис. 7.6). Клетки, в геном которых включился ген HIS4, растут на среде без гистидина; этот признак может ис-пользоваться для их отбора. Вторым критерием отбора служит замедление роста клеток в присутствии метанола, поскольку после потери гена АОХ1 после двойного кроссинговера активным остается только один, менее эффективный ген АОХ2. Клон с интегрировавшим фрагментом AOXlp-HBsAg-AOXlt при росте в присутствии метанола, который активирует /ША7-промотор, синтезировал в больших количествах аутентич-ный белок HBsAg, накапливающийся в цитоплазме. Белковый продукт образовывал такой же мудьтисубъединичный комплекс, как и соответствующий белок в клетках человека, инфицированных вирусом гепатита В, и связывался с антителами к этому вирусу. При выращивании данного клона в 240-литровом ферментере периодического действия количества синтезируемого белка хватило бы примерно на 107 вакцинаций. При этом генетическая конструкция оставалась неизменной в течение 200 часов
культивирования в присутствии метанола.
15. Опишите системы экспрессии с использованием культур клеток насекомых.
Бакуловирусы инфицируют только беспозвоночных, в том числе многих насекомых. В ходе инфекционного процесса образуются две их формы. Одна представлена отдельными вирионами, которые высвобождаются из инфицированной клетки хозяина, как правило клетки средней кишки, и способны инфицировать другие клетки этого органа. Вторая состоит из множества вирионов, заключенных в белковый матрикс. Белок этого матрикса называется полиэдрином, а сама структура — полиэдроном. Синтез полиэдрина продолжается, пока зараженные клетки не лизируют и хозяйский организм не погибнет. После этого множество таких частиц высвобождается и попадает в среду, где от инактивации их защищает белковый матрикс.
Промотор гена полиэдрина чрезвычайно сильный, а цикл развития вируса не зависит от наличия самого гена. Следовательно, замена последнего геном чужеродного белка с последующей инокуляцией полученным рекомбинантным бакуловирусом культуры клеток насекомого может привести к синтезу большого количества гетерологичного белка, который благодаря сходству систем внесения посттрансляционных модификаций у насекомых и млекопитающих будет близок (а возможно, и идентичен) к нативной форме того белка, который интересует исследователя. Исходя из этого на основе бакуловирусов были разработаны векторы для экспрессии генов, кодирующих белки млекопитающих и вирусов животных.
Наиболее широко используется вирус множественного ядерного полиэдроза Autographacalifornica (AcMNPV). Этот бакуловирус инфицирует более 30 других видов насекомых, а также хорошо растет в культуре многих клеточных линий. Линии клеток, обычно использующиеся для работы с рекомбинантным AcMNPV, получают из гусениц Spodopterafrugiperda.
 2020-01-14
2020-01-14 323
323








