При изучении электропроводности растворов следует остановиться на удельной и эквивалентной электропроводности.
Удельной электропроводностью (κ) раствора называется электропроводность слоя раствора длиной 1 м, заключенного между электродами площадью 1 м 2, находящимися на расстоянии 1 м друг от друга. В системе СИ удельная электропроводность выражается в См/м.
Электропроводность такого объема раствора, в котором содержится 1 г / моль растворенного вещества, заключенный между электродами большой площади, находящимися друг от друга на расстоянии 1 м, называется молярной или эквивалентной (l). В системе СИ молярная электропроводность выражается в См · м2/моль.
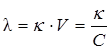 , ,
|
где V – разведение раствора, т.е. объем, в котором содержится 1 г / моль растворенного вещества; С – концентрация раствора.
Молярная электропроводность с увеличением разведения сначала возрастает, стремясь к определенному пределу – постоянной величине l∞, а затем перестает изменяться. l∞ называется молярной электропроводностью при бесконечном разведении и характеризует такое состояние раствора, при котором ионы уже не взаимодействуют друг с другом. В таком растворе молярная электропроводность определяется по закону Кольрауша как сумма электропроводностей ионов:
|
|
|
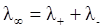 , ,
|
где l+ и l– – электропроводности или предельные подвижности катиона и аниона (табличные величины).
Для растворов многих электролитов связь степени и константы электролитической диссоциации с электропроводностью раствора выражается уравнениями:
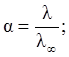
| |
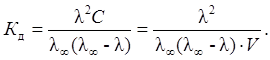
|
Последнее уравнение называется законом разбавления Оствальда и этому закону подчиняются разбавленные растворы только слабых электролитов.
Известно, что окислительно-восстановительные процессы (ОВП) можно разделить на две группы:
1. ОВР под действием электрического тока – электролиз.
2. ОВР, генерирующие электрический ток, – гальванический элемент. Этот процесс протекает самопроизвольно (DG<0) и находит широкое применение при создании батареек, аккумуляторов, топливных элементов и т.д.
Если металлическую пластинку поместить в раствор электролита, содержащего одноименный катион, то на границе раздела фаз возникнет двойной электрический слой. Он состоит из двух областей:
а) густая (гельмгольцевская, плотная) – образована ионами вблизи поверхности металла и имеющая размер около 10–8 – 10–7 см;
б) диффузионная – образована ионами, находящимися от пластинки на расстоянии 10–7 – 10–3 см.
В результате образования двойного электрического слоя возникает разность потенциалов, которая равна сумме падения потенциала в этих областях j = jг + jд.
|
|
|
Таким образом, разность потенциалов, возникающая на границе раздела фаз металл – электролит называется электродным потенциалом.
При увеличении концентрации электролита диффузионная зона сужается, а при с = 1 моль/л ее уже практически нет. В этом случае падение потенциала подчиняется законам плоского конденсатора, для которого справедливо выражение: DG = –njF, где F – число Фарадея (96500), DG – энергия Гиббса, n – количество электронов в ОВП:
 Me + mH2O – nē [Me(H2O)m]n+
Me + mH2O – nē [Me(H2O)m]n+
Если в уравнении изотермы: ΔG = ΔG0 + RTlnaMen+ каждый член разделить на nF, мы получим выражение для электродного потенциала, названное уравнением Нернста:
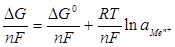 ;
; 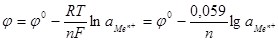
 В современной справочной литературе приведены величины φ0 – стандартный электродный потенциал (в случае любых ОВР он называется восстановительным) для процесса восстановления: Men+ + nē Me при стандартных условиях.
В современной справочной литературе приведены величины φ0 – стандартный электродный потенциал (в случае любых ОВР он называется восстановительным) для процесса восстановления: Men+ + nē Me при стандартных условиях.
Характеристикой ОВП в целом служит электродвижущая сила, которая равна разности электродных (восстановительных) потенциалов окислителя и восстановителя:
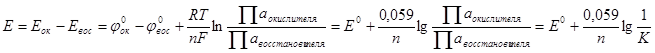
где К – константа равновесия ОВР.
Гальваническим элементом называют совокупность последовательно соединенных проводящих фаз, из которых по крайней мере одна является проводником II рода- раствором или расплавом электролита. Э.Д.С. гальванического элемента (разность потенциалов на концах разомкнутого элемента) равна сумме скачков потенциала на границах раздела различных фаз, из которых составлен элемент.
Электродом или полуэлементом называют совокупность двух контактирующих фаз, из которых одна обязательно является проводником II рода (раствором или расплавом электролита), а другая (материал электрода) может быть металлическим проводником, полупроводником или проводящей мембраной; возникновение электродного потенциала обусловлено электродной реакцией, протекающей в электроде на границе раздела фаз.
Все электроды подразделяют на обратимые и необратимые. Обратимыми называют электроды, в которых электронные реакции обратимы и электродный потенциал которых (при данной постоянной температуре) зависит только от концентрации компонентов, принимающих участие в электродной реакции.
Примерами обратимых электродов может служить металлический электрод Cu/CuSO  , газовый электрод Pt, Cl
, газовый электрод Pt, Cl 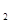 /KCl и т.п. Все электроды, не удовлетворяющие вышеуказанным условиям, являются необратимыми. Примерами их могут служить металлический электрод Zn/CuSO
/KCl и т.п. Все электроды, не удовлетворяющие вышеуказанным условиям, являются необратимыми. Примерами их могут служить металлический электрод Zn/CuSO 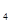 , газовый электрод Pt, Cl
, газовый электрод Pt, Cl 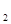 /K
/K 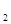 SO
SO  и т.п.
и т.п. 
Простейший гальванический элемент (элемент Даниэля) будет функционировать и генерировать электрический ток до тех пор, пока не наступит состояние равновесия. Следует иметь в виду, что вместо медной пластинки можно использовать пластинку из любого металла, стоящего в ряду напряжения после цинка, а вместо раствора ZnSO4 – раствор любого электролита. Существует краткая форма записи элемента Даниэля:
(–) Zn | ZnSO4 || CuSO4 | Cu (+),
c1 c2
где с1 и с2 – молярная концентрация электролитов.
Если с1 = с2 = 1 моль/л, то э.д.с. элемента Даниэля:
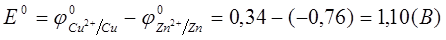
ЛИТЕРАТУРА: [1, § 153-158, 166, 167, 171, 173. 175. 176].
Вопросы для самопроверки
1. Каков механизм прохождения тока в проводниках первого и второго рода?
2. Изложите основные положения теории электролитической диссоциации Аррениуса.
3. По каким признакам электролиты относят к сильным и слабым?
4. Какова зависимость эквивалентной электропроводности от разбавления?
5. Какие электролиты подчиняются закону разбавления Оствальда?
6. Как образуется двойной электрический слой на границе металл-раствор?
7. Напишите формулу Нернста для определения электродного потенциала.
8. Что такое электродный потенциал и нормальный электродный потенциал?
|
|
|
9. Что такое ряд напряжений? Значение каких электродных потенциалов указаны в нем?
 2020-01-14
2020-01-14 233
233








