1. Прежде всего необходимо переписать вопрос задания в тетрадь.
2. Затем дать четкий и краткий ответ на теоретический вопрос, предварительно проработав материал учебника.
3. Оформление решения задачи следующее: написать, что дано; что надо определить; ход решения с применением законов, правил, формул и объяснением их; ответ задачи.
Все задачи по данному курсу решаются с использованием соответствующих законов, правил, формул, поэтому в тетради надо обязательно указать, на основании какого закона, правилаВырешаете задачу; привести формулировку закона, правила; объяснить значение всех величин, входящих в формулы. Найти (путем подстановки размерностей входящих в формулу величин) размерность конечной величины, затем подставить в уравнение числовые значения и дать ответ.
При простой подстановке числовых величин в формулубезобъяснения хода решения задача не будет считаться решенной.
ТЕМА 1
Задание данной темы состоит из теоретического вопроса и задачи. Теплоты образования веществ, необходимые для решения задач, приведены в табл.3. Ответ задачи надо дать в кДж/моль и в ккал/моль.
Знак «-» перед тепловыми эффектами (например, для оксида железа) означает, что при образовании оксида железа из железа и молекул кислорода теплота выделяется.
Таблица 3
| Вещество ТЕМА I При выполнении задач этой темы воспользуйтесь советами, данными на с.6- Задание данной темы состоит из теоретического вопроса и задачи. Теплоты образования веществ, необходимые для решения задачи приведены в табл. 3. Ответ задачи надо дать в кДж/моль и в ккал/моль. Знак «—» перед тепловыми эффектами (например, для окисла железа) означает, что при образовании окисла железа из железа и молекул кислорода теплота выделяется. Т а б л к ц а 3 Теплоты образования соединений при 25С (298К) в кДж/моль-1 Вещество | ∆Нобр | Вещество г | ∆Н0 |
| 1 | 2 | 3 | 4 |
| Fе2О3 (тв) | -821,3 | СН4(г) | - 74,85 |
| Н2О (г) | -241.8 | С2Н6(г) | - 84,67 |
| Н20 (ж) | -285,8 | СзН8 (г) | -103,9 |
| NО (г) | + 90,37 | С6Н14 (ж) | -198,8 |
| N02 (г) | + 33,89 | С2Н2, (г) | +226,75 |
| СО (г) | -110,5 | С6Н6 (г) | + 82,9 |
| СО2 (г) | -393,5 | С6Н6(ж) | + 49,0 |
| NH3 (г) | - 46,2 | С2Н4(г) | + 52,28 |
| КС1 (тв) | -435,9 | С7Н8 (ж) | + 8,08 |
| NаС1 (тв) | -410,9 | С2Н5ОН(ж) | -227,6 |
| С(алмаз) тв.) | + 1,89 | СНзСООН (ж) | -484,9 |
| СНзОН (ж) | -238,7 | (СН2ОН)2 (ж) | -454,9 |
| НСООН (ж) | -422,8 | СН3СОСНз (ж) | -469,5 |
| С6Н21 (ж) | -156,5 | СНзСООС2Н5 (ж) | -247,7 |
| СзН6 (г) | + 20,4 | С12H22O11(тв) | -2221,0 |
| C8H18(ж) | -159,3 | С6Н5СООН (ж) | -385,2 |
| С8Н10 (ж) | - 24,34 |
1. Какова связь между внутренней энергией и энтальпией системы? Дайте определение внутренней энергии и энтальпии. Определите теплоту образования бензола из элементов, если теплота сгорания его равна — 3184 кДж/моль.
2. Объясните, в каких случаях при протекании химической реакции изменение энтальпии равно по абсолютной величине тепловому эффекту химической реакции. Определите тепловой эффект реакции сгорания метана.
3. Что называется термодинамической системой? Дайте определение понятий: изолированная, открытая, закрытая система. Определить теплоту образования ацетона из элементов, если теплота сгорания его равна — 1788 кДж/моль.
4. Напишите математическое выражение объединенного (первого и второго) закона термодинамики. Определите тепловой эффект реакции сгорания ацетилена.
5. Дайте определение характеристической функции. Перечислите все известные Вам характеристические функции. Определите теплоту образования уксусной кислоты из элементов, если теплота ее сгорания равна — 877,4 кДж/моль.
6. Что называется внутренней энергией системы? Можно ли определить абсолютную величину внутренней энергии? Определите тепловой эффект реакции сгорания этана.
7. Что такое необратимый термодинамический процесс? Приведите примеры таких процессов. Определите теплоту образования ксилола из элементов, если теплота сгорания его равна — 4370 кД ж/моль.
8. Дайте определение энтропии. Как по изменению энтропии в изолированной системе определить состояние равновесия? Определите теплоту сгорания ацетона.
9. Дайте формулировку закона Гесса. Почему тепловой эффект реакции не зависит от пути протекания ее? Приведите примеры. Определите теплоту образования пропилена из элементов, если теплота сгорания его равна—2062 кДж/моль.
10. Дайте формулировку первого закона термодинамикии егоматематическое выражение. Определите тепловой эффект реакции сгорания циклотексана (ж).
11. Что такое физико-химическая система? Приведите примеры. Что такое гомогенная и гетерогенная системы? Примеры. Определите тепловой эффект реакции окисления аммиака до оксида.азота (II) и воды.
12. Что такое обратимый термодинамический процесс? Примеры. Определите тепловой эффект сгорания ацетилена.
13. Что такое функция состояния системы? Определите величину теплового эффекта реакции:
2 S + 3 O2 = 2 SO3, если известны тепловые эффекты реакций
а) S + O2 = SO2 + 297 кДж/моль
б) SO2 + 0,5 O2 = SO3 + 396 кДж/моль.
14. Каков физический смысл внутренней энергии системы как функции состояния? Сколько энергии надо затратить для разложения 9 г воды на водород и кислород в стандартных условиях?
15. Что такое энтальпия системы? Исходя из термохимических уравнений реакций:
KClO3 = KCl + 3/2 O2 (DНо298 = -49,4 кДж/моль);
KСlO4 = KCl + 2 O2 (DНо298 = 33 кДж/моль),
рассчитайте DНо298 для реакции: 4 KClO3 = 3 KClO4 + KCl.
16. Что называется тепловым эффектом реакции? При каких условиях он называется изменением энтальпии реакции и обозначается ∆Н0?
С помощью термохимического уравнения
Н2S(г) + 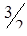 O2 = H2O(ж) + SO2(г) + 562,8 кДж
O2 = H2O(ж) + SO2(г) + 562,8 кДж
Определите объем сгоревшего сероводорода, если известно, что в результате реакции выделилось 281,4 кДж теплоты.
17. Что называется стандартной энтальпией образования соединения  Н0обр.? Реакция восстановления
Н0обр.? Реакция восстановления 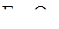 водородом протекает по уравнению:
водородом протекает по уравнению:

Возможна ли эта реакция при стандартных условиях, если изменение энтропии  = 0,1387 кДж/(моль×К)? При какой температуре начнется восстановление
= 0,1387 кДж/(моль×К)? При какой температуре начнется восстановление  ?
?
18. Изменение теплоты реакции можно выразить через величины ∆Н и  U. В чем различие между ними? Вычислите, какое количество теплоты выделится при восстановлении
U. В чем различие между ними? Вычислите, какое количество теплоты выделится при восстановлении  металлическим алюминием, если было получено 335,1 г железа.
металлическим алюминием, если было получено 335,1 г железа.
19. Что называется стандартной энтропией вещества? Газообразный этиловый спирт  можно получить при взаимодействии этилена
можно получить при взаимодействии этилена  и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
20. Почему энтропия твердого тела меньше, чем у газа, полученного из него?
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод  . Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
21. Что означает энергия Гиббса? Напишите термохимическое уравнение реакции между  и водородом, в результате которой образуются
и водородом, в результате которой образуются  и
и 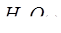 . Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана?
. Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана?
22. Напишите математическое выражение объединенного (первого и второго) закона термодинамики. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака?
23. Дайте определение характеристической функции. Перечислите все известные Вам характеристические функции. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования  .
.
24. Дайте определение энтропии. Как по изменению энтропии в изолированной системе определить состояние равновесия? При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования  .
.
25. Дайте формулировку закона Гесса. Почему тепловой эффект реакции не зависит от пути протекания ее? Приведите примеры. При сгорании 1 л ацетилена (н. у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С 2 Н 2(г).
ТЕМА ІІ и ІІІ.
26. Найдите константы равновесия Кр; и Кс для реакции
CaCl2 (kp) + H2O(г) – СО2(г) <==> СаСО3(кр) + 2 НCl(г), если парциальные давления газообразных веществ равны:
PНСl = 0.02 атм, PН2О = 0.7 атм, Pco2 = 1.2 атм при 115оС.
27. Вычислить давление паров воды над 25%-ным раствором  при
при  , если
, если  мм.рт.ст.
мм.рт.ст.
28. При 292 К давление паров  равно 0,11276 атм. Давление над раствором, содержащим неэлектролит А массой 2,182 г в 100 г
равно 0,11276 атм. Давление над раствором, содержащим неэлектролит А массой 2,182 г в 100 г 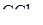 равно 0,11066 атм. Вычислите
равно 0,11066 атм. Вычислите  . Установите формулу А, если в А содержится по массе 94,34% углерода и 5,66% водорода.
. Установите формулу А, если в А содержится по массе 94,34% углерода и 5,66% водорода.
29. При какой температуре кипит 5%-ный раствор  в воде?
в воде?
30. Температура кипения 
 , а
, а 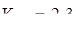 . Вычислите М бензойной кислоты в сероуглероде, если раствор, содержащий 0,9373 г кислоты в 50 г
. Вычислите М бензойной кислоты в сероуглероде, если раствор, содержащий 0,9373 г кислоты в 50 г  кипит при
кипит при 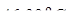 . Объясните результат.
. Объясните результат.
31. Сколько граммов глицерина  следует добавить к 1,0 кг
следует добавить к 1,0 кг  , чтобы раствор не замерзал при
, чтобы раствор не замерзал при  ?
?
32. Раствор, в 1 л которого содержится 4,054 г вещества имеет 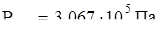 Вычислите М вещества.
Вычислите М вещества.
33. Сколько граммов 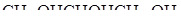 надо растворить в
надо растворить в 
 , чтобы
, чтобы  при
при  ?
?
34. Осмотическое давление  раствора
раствора  при
при  равно
равно  . Вычислите
. Вычислите  .
.
35. Вычислите  в 2%-ном растворе
в 2%-ном растворе 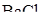
 при
при  .
.
36. Температура кристаллизации 10%-ного раствора  равна
равна  . Вычислите
. Вычислите  .
.
37. Давление пара воды при  равно 7,24 кПа, а над 5%-ным раствором
равно 7,24 кПа, а над 5%-ным раствором  7,129 кПа. Вычислите
7,129 кПа. Вычислите  .
.
38. Раствор, содержащий 0,171г  в 1000г
в 1000г  замерзает при
замерзает при  . Определите изотонический коэффициент (і).
. Определите изотонический коэффициент (і).
39. Температура замерзания водного раствора 
 . Вычислить
. Вычислить  раствора при этой температуре, если
раствора при этой температуре, если  .
.
40.На основании принципа Ле-Шателье определите, увеличится ли выход продуктов при одновременном понижении температуры и давления в системах:
a) С(т) + O2(г) Û СO2(г); ∆ Н ° < 0
б) Н2(г) + I2(т) Û 2 HI(г); ∆ Н ° > 0
в) 6 HF(г) + N2(г) Û 2 NF3(г) + 3 H2(г); ∆ Н ° > 0
г) 2 O3(г) Û 3 O2(г)); ∆ Н ° < 0
д) 2 CO(г) Û 2 C(т) + O2(г); ∆ Н ° > 0
е) I2(т) + 5 CO2(г) Û I2O5(т) + 5 CO(г); ∆ Н ° > 0
41.На основании принципа Ле-Шателье определите, увеличится ли выход продуктов при повышении температуры и понижении давления одновременно:
a) С(т) + H2O (г) Û СO(г) + H2(г); ∆ Н ° > 0
б) 2 NO(Cl)(г) + Br2(г) Û 2 NO(Br)(г) + Cl2(г); ∆ Н ° > 0
в) CO(г) + 2 H2(г) Û CH3OH(г); ∆ Н ° < 0
г) N2O4(г) Û 2 NO2(г)); ∆ Н ° > 0
д) 8 H2S(г) + 8 I2(т) Û S8(т) + 16 HI(г); ∆ Н ° > 0
е) 2 CO(г) + O2(г) Û 2 CO2(г); ∆ Н ° < 0
43.Предложите оптимальное изменение термодинамических параметров Т и р для увеличения выхода продуктов в системах.:
a) Н2(г) + Br2(г) Û 2 HBr(г); ∆ Н ° < 0
б) N2(г) + 3 H2(т) Û 2 NH3(г); ∆ Н ° < 0
в) SO3(г) + NO(г) Û SO2(г) + NO2(г); ∆ Н ° > 0
г) PCl5(г) Û PCl3(г) + Cl2(г); ∆ Н ° > 0
д) CO2(г) + 2 SO3(г) Û CS2(г) + 4 O2(г); ∆ Н ° > 0
е) 2 CuO(т) + CO2(г) + H2O(г) Û Cu2CO3(OH)2(т); ∆ Н ° < 0
44. При Т = const состояние равновесия реакции
CuO(т) + H2(г) Û Cu(т) + H2O(г)
установилось при концентрации каждого газообразного вещества 0,55 моль/л. Затем увеличивают концентрации на 2 моль/л H2 и на 0,5 моль/л H2O, чем вызывают смещение равновесия. Определите новые значения равновесных концентраций газообразных веществ.
45. Определите значения (в моль/л) равновесных концентраций газообразных веществ для реакции
Fe2O3(т) + 3 CO(г) Û 2 Fe(т) + 3 CO2(г); K С = 0,125
протекающей при некоторой температуре, если в некоторый момент концентрации газообразных веществ составляли 0,5 (СО) и 0,1 мольл (СО2).
46. Рассчитайте равновесные концентрации газообразных веществ для реакции
LiH(т) + H2O(г) Û LiOH(ж) + H2(г); K С = 2,21
протекающей при Т = const, если в некоторой момент времени концентрации газообразных веществ были равны 0,75 мольл (H2O) и 0,15 мольл (H2).
47. При Т = const состояние равновесия реакции
Fe2O3(т) + 3H2(г) Û 2Fe(т) + 3H2O(г)
установилось при концентрациях H2 и H2O соответственно 0,35 и 0,15 мольл. После увеличения концентрации водорода на 1,5 мольл произошло смещение равновесия. Рассчитайте новые значения равновесных концентраций газообразных веществ.
48. В реакторе объемом 0,25 л проводят реакцию
Sb2S3(т) + 3 CO(г) Û 2 Sb(т) + 3 CSO(г)
при Т = const, равновесная концентрация каждого газообразного вещества равна 0,3 мольл. Для смещения равновесия добавляют 0,1 моль монооксида углерода. Определите новые равновесные концентрации газообразных веществ.
49.При Т = const состояние равновесия реакции
2 ZnS(т) + 3 O2(г) Û 2 ZnO(т) + 2 SO2(г); K С = 12,5
установилось при равновесной концентрации кислорода, равной 0,5 мольл. Установите концентрацию SO2 в некоторый момент протекания реакции, если концентрация O2 в этот момент равна 2 мольл.
50.При Т = const состояние равновесия реакции
2 PbS(т) + 3 O2(г) Û 2 PbO(т) + 2 SO2(г); K С = 0,54
установилось при равновесной концентрации диоксида серы, равной 1,35 мольл. Определите концентрацию O2 в некоторый момент протекания реакции, если концентрация SO2 в этот момент составляла 2 мольл.
51. Рассчитайте константу равновесия реакции
3 Fe(т) + 2 СО(г) Û Fe3С(т) + СO2(г)
если при некоторой температуре в реактор объемом 5 л помещена навеска железа и введена смесь 1,05 моль СО и 0,05 моль СO2, а к моменту наступления равновесия количество диоксида углерода увеличилось на 0,5 моль.
52. Что такое гетерогенная система? Дайте определение понятий: составная часть и компонент. Найдите число степеней свободы системы, состоящей из видного раствора спирта, глюкозы, в присутствии паров воды и льда.
53. Сформулируйте правило фаз Гиббса. Найдите число степеней свободы для следующей неоднородной системы: водный раствор N30 и СаС1а в присутствии соли NаNOз, льда и паров воды с учетом того, что в данной системе протекает реакция:
СаСl2 + 2 NаNОз <==> Са (NO3)2 +2NaCl.
54. Вычислите константы равновесия Кр и Кс для реакции
СО2(г) + Н2(г) <==> СО(г) + Н2О(г),
если парциальные давления газообразных веществ равны: Рсо2 = 0,25 атм, PH2 = 0.25 атм, Рсо =0,5 атм, PН2o = 0,1 атм при 880°С.
Объясните, когда Кp равно Кс.
55. Приведите пример гетерогенной системы, в которой число компонентов равно числу составных частей. Чему равно число степеней свободы системы
4 Fе(кр)+.3O2 (г) <==>2Fe2О3 (кр)
56. Найдите константы равновесия Кр и Кc для реакции.
4НCl(г) +O2 (г) <==> 2Н2(г) +2H2O(г),
если парциальные давления газообразных веществ равны:
Ро2=0,2 атм, РНСl==0,Затм, Рн2о=0,1атм, РCl2 ==0,15 атм при 767° С.
57. Приведите пример гетерогенной системы, в которой число компонентов не равно числу составных частей. Найдите число степеней свободы для следующей гетерогенной системы: раствор солей KCl, NaCl лед и пары воды.
58. Вычислите константы равновесия Кр и Кс для реакции
2 С(кр) + 3Н2 (г) <==> С2Н6 (г)
если парциальные давления газообразных веществ Рн2 = 1,2 атм, Рс2н6 = 0,5 атм при 977о С.
59. Вычислите Кр и Кс химического равновесия реакции:
2СuС1 + Н2 <==> 2 НС1 + 2Сu,
если парциальные давления газообразных компонентов равны:
Рн2 = 0.6 атм, РНСl= 0,8 атм, реакция идет при температуре 400°С.
60. Сформулируйте правило фаз Гиббса. Определите число степеней свободы для следующей неоднородной системы: раствор сернокислого натрия, кристаллы Na2SO4 ∙10H2O, кристаллы Na2SO4, пары воды.
61. Гетерогенная реакция 2С+О2<==>2СО (г) протекает при температуре 520°С, равновесные (парциальные) давления газов равны Ро2 = 0,93 атм и Рсо ==0,07 атм. Вычислить константы Кр к Кс. Объясните, когда Кр равно Кс.
62. Напишите константу равновесия реакции N2+ЗН2<==>2NH3 и укажите, какими способами можно сместить равновесие в сторону образования аммиака.
63. Найдите константу равновесия Кр и Кс для реакции
С(кр) + О2(г)<==> СО2 (г)
если парциальные давления газов равны:Ро2=0,8 атм, Рсо2,= 0,6 атм, при 250° С.
ТЕМА ІY и Y.
При решении задач используйте данные таблицы стандартных значений нормальных электродных потенциалов
64. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из медного и железного электродов, опущенных в 0,2 М раствор сульфата железа (ІІ) и 0,1 М раствор сульфата меди. Напишите реакцию, протекающую в гальваническом элементе.
65. Объясните зависимость эквивалентной электропроводности от разбавления. Приведите графикэтой зависимости. Степень диссоциации пропионовой кислоты равна 1,3% при концентрации раствора 0,12 М. Вычислите константу диссоциации.
Таблица. Стандартные электродные потенциалы (Е °) в водных растворах при 25о С
| Электрод | Электродная реакция | Е °, В |
| 1 | 2 | 3 |
| Ag/Ag+ |  | +0,799 |
| Al/Al+3 |  | –1,662 |
| Ba/Ba+2 |  | –2,906 |
| Be/Be+2 |  | –1,847 |
| Bi/Bi+3 |  | +0,210 |
| 2Br–,Br2/Pt | 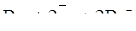 | +1,070 |
| Ca/Ca+2 |  | –2,866 |
| Cd/Cd+2 |  | –0,402 |
| 2Cl–,Cl2/Pt |  | +1,360 |
| Co/Co+2 |  | –0,270 |
| Co+2/Co+3 |  | +1,810 |
| Cr/Cr+3 |  | –0,740 |
| Cr+3, Cr2O72–, H+/Pt |  | +1,330 |
| Cr+3,Cr+2/Pt |  | –0,408 |
| Cu/Cu+2 |  | +0,340 |
| Cu+/Cu+2 |  | +0,150 |
| Cu/Cu+ |  | +0,521 |
| Fe/Fe+2 |  | –0,440 |
| Fe/Fe+3 |  | –0,040 |
| Fe+3,Fe+2/Pt |  | +0,770 |
 |  | +0,360 |
| H2,2H+/Pt |  | 0,000 |
| H– / H2, Pt |  | +2,200 |
| Hg/Hg+2 |  | +0,854 |
| Hg2+,Hg+/Pt |  | +0,910 |
| J2,2J–/Pt |  | +0,540 |
| 1 | 2 | 3 |
| K/K+ |  | –2,925 |
| Li/Li+ |  | –3,045 |
| Mg/Mg+2 |  | –2,360 |
| Mn/Mn+2 |  | –1,180 |
| MnO4–, MnO42–/Pt |  | +0,564 |
| Mn2+, H+/MnO2, Pt |  | +1,230 |
| MnO4–, H+/MnO2, Pt |  | +1,695 |
| Mo/Mo+3 |  | –0,200 |
| Na/Na+ |  | –2,714 |
| Ni/Ni+2 | 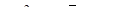 | –0,240 |
| O2,OH–/Pt |  | +0,401 |
| Pb/Pb+2 |  | –0,126 |
| Pb+2/Pb+4 |  | +1,690 |
| Pb+2, H+/ PbO2, Pt |  | +1,455 |
| Pd/Pd+2 |  | +0,987 |
| Pt/Pt+2 |  | +1,190 |
| Rb/Rb+ |  | –2,925 |
| S2–/S |  | –0,510 |
| Sb/Sb+2 |  | +0,200 |
| SbO2–/Sb |  | –0,670 |
| Se2–/Se |  | –0,770 |
| Sn/Sn+2 |  | –0,140 |
| Sn+2/Sn+4 |  | +0,150 |
| SO42–, H+/ PbSO4, PbO2, Pb |  | +1,682 |
| Zn/Zn+2 |  | –0,760 |
| Ti/Ti+2 |  | –1,628 |
| V/V+2 |  | –1,186 |
| WO42–/W |  | –1,050 |
66. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из железного и цинкового электродов, опущенных в 0,05 М раствор сульфата цинка и 0,15 М раствор сульфата железа (II). Напишите реакцию, протекающую в гальваническом элементе.
67. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из никелевого и кадмиевого электродов, опущенных в 0,07 М раствор сульфата никеля и 0,3 М раствор нитрата кадмия. Напишите реакцию, протекающую в гальваническом элементе.
68. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из медного и свинцового электродов, опущенных в 0,1 М раствор сульфата меди и 1,0 М раствор нитрата свинца. Напишите реакцию, протекающую в гальваническом элементе.
69. Опишите устройство гальванического элемента Даниэля - Якоби и объясните причины возникновения электродного потенциала. Примените формулу Нернста для вычисления ЭДС.
70. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из свинцового и цинкового электродов, опущенных в 0,5 М раствор хлорида цинка и 0,05 М раствор нитрата свинца. Напишите реакцию, протекающую в гальваническом элементе.
71. Что такое нормальный электродный потенциал? Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из цинкового и никелевого электродов, опущенных в 0,3 М раствор нитрата цинка и 0,03 М раствор хлорида никеля. Напишите реакцию, протекающую в гальваническом элементе.
72. Что такое контактный потенциал? Объясните причину его возникновения. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из цинкового и никелевого электродов, опущенных в 0.3 М раствор нитрата цинка и 0,03 М раствор хлорида никеля. Напишите реакцию, протекающую в гальваническом элементе.
73. Что такое контактный потенциал? Объясните причину его возникновения. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из медного и железного электродов, опущенных в 0,2 М раствор сульфата меди и 0,1 М раствор сульфата железа (II). Напишите реакцию, протекающую в гальваническом элементе.
74. Что такое диффузионный потенциал? Объясните причину его возникновения. Составьте схему цепи и вычислите ЭДС гальванического элемента, составленного из медного и цинкового электродов, опущенных в 0,1 М раствор сульфата меди и 0,5 М раствор сульфата цинка. Напишите реакцию, протекающую в элементе.
75. Что такое электродный потенциал? Объясните причину его возникновения. Составьте схему цепи и вычислите ЭДС гальванического элемента, состоящего из железного и цинкового электродов, опущенных в 0,3 М раствор сульфата цинка и 0,15 М раствор сульфата железа (II). Напишите реакцию, протекающую в гальваническом элементе.
76. Что такое контактный потенциал? Объясните причину его возникновения. Вычислите э.д.с. Ag | Ag+ || Ag+ | Ag.
0,1М 0,01М
77-92. Многовариантная задача
Определите, чему равна молекулярность следующих элементарных реакций (см. следующую таблицу):
| № задачи | Реакции | |
| 77 | 2NO + Cl2 → 2NOCl | 2Н2 + СО → СН3ОН (г) |
| 78 | С2Н2 + 2Н2О (ж) → СН3СООН (ж) + Н2 | Сl2 + H2 → 2HCl; |
| 79 | 4HCl + O2 → 2Н2О (г) + 2Cl2 | N2 + 3H2 → 2NH3 |
| 80 | MgO + Н2О (г) → Mg(OH)2 | N2O4 → 2N2O2 |
| 81 | CН4 + СО2 → 2CO + 2Н2 | NH4 + HCl → NH4Cl |
| 82 | CaO + CO2 → CaCO3 | C2H6 → C2H4 + H2 |
| 83 | S2 + 4CO2 → 2SO2 + 4CO | 2NO2 → 2NO + O2 |
| 84 | 4NO2 + 6H2O (г) → 4NH3 + 5O2 | CaO + Н2О (г) → Ca(OH)2 |
| 85 | 2N2 + 6H2O (г) → 2NH3 + 3O2 | CO + Cl2 → COCl2 |
| 86 | S2 + 4H2O (г) → 2SO2 + 4H2 | 2SO2 + O2 → SO3 |
| 87 | SO2 + Cl2 → SO2Cl2 | 2CO2 → 2CO + O2 |
| 88 | C2H5OH → C2H4 + H2O | CO2 + 3H2 → CH4 + H2O (г) |
| 89 | CO2 + H2 → CO + H2O | H2S + O2 → H2O + S (p) |
| 90 | C3H6 + Cl2 + H2O (ж) → HCl + C3H6(OH)Cl | 2HI → H2 + I2 |
| 91 | CH3CHO (г) + H2 → C2H5OH | 2H2O2 → O2 + 2H2O (ж) |
| 92 | CO + 4H2 → CH4 + 2H2O | 2CH4 + O2 → 2(C2H4)O (ж) |
93. На сколько градусов необходимо повысить температуру, чтобы скорость реакции возросла в 100 раз, если температурный коэффициент скорости равен 3?
94. Температурный коэффициент скорости реакции разложения йодистого водорода равен 2. Вычислить константу скорости этой реакции при 374о С, если при 356о С она равна 8,09·10-5.
95. Константа скорости реакции омыления этилацетата NaОН при 9,4о С равна 2,27, а при 14,4о С – 3,204. Рассчитать температурный коэффициент скорости реакции в указанном интервале температур.
96. Оксид азота (II) NO окисляется кислородом О2 с образованием оксида азота (IV) NO2 (в газовой фазе). Кинетическое уравнение этой реакции соответствует полному химическому уравнению. Как изменится скорость реакции, если давление увеличить в два раза? Исследуйте задачу: убедитесь в том, что ответ не зависит от молярного соотношения реагентов.
97. Реакция А + Б = В является бимолекулярной. Начальные концентрации веществ таковы: [А]н = 2,5 моль/л, [Б]н = 1,5 моль/л. Константа скорости реакции k = 0,8 л/моль.сек. Вычислите концентрацию вещества [А] и скорость реакции к моменту, когда концентрация вещества [Б] составит 0,5 моль/л.
98. При состоянии равновесия системы
N2 + 3H2  2NH3
2NH3
концентрации участвующих веществ были: [N2] = 0,3 моль/дм3, [H2] = 0,9 моль/дм3, [NH3] = 0,4 моль/дм3. Рассчитать, как изменятся скорости прямой и обратной реакций, если увеличить давление в 5 раз. В каком направлении будет смещаться равновесие?
ТЕМА YI.
99. Определить поверхностный избыток Г (кмоль/м2) для водного раствора фенола с концентрацией 0.0625 кмоль/м3 при 20о С, для которого величина поверхностного натяжения равна 43.3*10-3 н/м если для раствора с концентрацией фенола 0.0156 кмоль/м3 величина поверхностного натяжения равняется 58.2*10-3 н/м.
100. Определить поверхностный избыток Г (кмоль/м2) для водных растворов изовалерьяновой кислоты при 15о С, если для растворов с концентрацией 0.0312 кмоль/м3 и 0.25 кмоль/м3 величина поверхностного натяжения меняется от 57.5*10-3 до 35.0*10-3 н/м соответственно. Поверхностное натяжение воды при этой температуре равно 73.79*10-3 н/м.
101. Определить поверхностный избыток Г (кмоль/м2) для 20% раствора серной кислоты при 18о С, если поверхностное натяжение раствора равно 75.2*10-3 н/м, а для воды 73.05*10-3 н/м. Плотность 20% раствора серной кислоты 1.143 г/см3.
102. Определить поверхностный избыток Г (кмоль/м2) и его знак для 20% раствора едкого натра при 20о С, если поверхностное натяжение раствора равно 85.8*10-3 н/м, а для воды 72.75*10-3 н/м. Плотность 20% раствора едкого натра 1.219 г/см3.
103. Определить поверхностный избыток Г (кмоль/м2) и его знак при 15о С для водного раствора, содержащего 29 г/л ацетона, если поверхностное натяжение раствора равно 59.4*10-3 н/м, а для воды при этой температуре 73.79*10-3 н/м.
104. Определить поверхностный избыток Г (кмоль/м2) и его знак для 5% раствора лимонной кислоты при 20о С, если поверхностное натяжение раствора равно 80.1*10-3 н/м, а для воды 72.75*10-3 н/м. Плотность 5% раствора лимонной кислоты 1.021 г/см3.
105. Определить поверхностный избыток Г (кмоль/м2) и его знак для 3% раствора стеарата натрия при 20о С, если поверхностное натяжение раствора равно 27.1*10-3 н/м, а для воды 72.75*10-3 н/м. Плотность 3% раствора стеарата натрия 1.083 г/см3.
106. Опишите три основных признака коллоидно-дисперсного состояния и определите, какая из указанных ниже систем является коллоидной и почему:
а) раствор каучука в бензоле; б) пудра; в) рубин.
107. Найдите величину смещения коллоидной частицы при броуновском движении, радиус частицы 10-9м, время наблюдения 15 с, температура 25°С, вязкость среды 0,9 ∙10-3 Н-с/м2.
108. Классифицируйте нижеуказанные системы по агрегатному состоянию фаз и дисперсности: а) мука с размером частиц около 50 мкм; б) взбитый яичный белок с размером пузырьков 1 мм; в) гидрозоль золота с размером частиц 0,025 мкм. Перевести микрометры (мкм) в см.
109. Классифицируйте нижеуказанные системы по агрегатному стоянию фаз и дисперсности: а) гидрозоль серы с размером частиц 0,05 км; б) мыльная пена с размером частиц 10 мкм: в) чугун с размером включений углерода около 0,5 мкм. Перевести микрометры (мкм) в см.
110. Вычислите радиус частиц дисперсной фазы, если скорость седиментации их равна 10-6 м/с, плотность 2*103 кг/м3, плотность среды 103 кг/м3, вязкость среды 2*10 3 Н с/м2.
111. Величина смещения коллоидной частицы за 5 с наблюдений составила 10∙10-6 м при температуре 35°С и вязкости среды 0,7.10-3 Н с/м2. Найдите радиус частицы.
112.Классифицируйте нижеуказанные системы по агрегатному состоянию фаз и дисперсности: а) пудра с размером частиц около 10 мкм; б) жидкие парфюмерные кремы с размером частиц 2 мкм; в) зубная паста, содержащая частицы оксида титана размером 0,25 мкм. Перевести микрометры (мкм) в см.
113. Опишите три основных признака коллоидно-дисперсного состояния и определите, какие из указанных ниже систем являются микрогетерогенными и почему: а) густотертые масляные краски; б) мыльная пена; в) раствор хлорида натрия.
114. Классифицируйте нижеуказанные системы по агрегатному, состоянию фаз и дисперсности: а) парфюмерные твердые кремы с размером частиц 0,5 мкм; б) рубиновые камни, содержащие оксид хрома с размером частиц около 0,005 мкм; в) частицы жира в молоке размером 2 мкм. Перевести микрометры (мкм) в см.
115. Имеются следующие системы: эмульсия касторового масла в воде с размером частиц 5•10-4 см, гидрозоль оксида железа с. размером частиц 0,05*10-4 см и порошок красителя с размером частиц 0,25*10-4 см. Классифицировать данные системы по агрегатному состоянию фаз и дисперсности.
116. Классифицируйте нижеуказанные системы по агрегатному состоянию фаз и дисперсности: а) струя краски из краскораспылителя - размер частиц около 30 мкм; б) ил на дне реки - 0,8 мкм; в) цветное стекло, окрашенное частицами золота - 0,02 мкм. Перевести микрометры (мкм) в см.
117. Число капель воды, вытекающей из сталагмометра, равно 39, число капель раствора моющего средства. - 70, поверхностное натяжение воды равно 72,7•10-ЗН/м. Рассчитать поверхностное натяжение раствора моющего средства, если плотности обоих систем равны. Что такое адсорбция?
118. Краевой угол воды на стекле равен 5°, на полиэтилене 80°, па сульфиде железа 70°, на карбонате кальция 25°. Расположите вещества в порядке уменьшения их гидрофильности. Ответ поясните.
119. Как зависит молекулярная адсорбция из растворов от полярностей адсорбента и среды? Приведите примеры. Определите энергию Гиббса поверхности 5 г тумана воды, если поверхностное натяжение составляет 71,96 мДж / м 2, дисперсность частиц 60 мкм –1, плотность воды 0,997 г / см 3.
120. Краевой угол воды на стекле равен 5°, на политетрафторэтилене 95°, на дисульфиде молибдена 85°, на мраморе 25°. Расположите вещества в порядке увеличения их гидрофильности. Ответ поясните.
121. Из набора адсорбентов (активированный уголь, силикагель; коалин) подобрать наилучший адсорбент для извлечения анилина из водного раствора. Ответ поясните. Определите энергию Гиббса поверхности 4 г тумана воды, если поверхностное натяжение составляет 72,7 мДж / м 2, дисперсность частиц 50 мкм –1, плотность воды 0,998 г / см 3.
122. Константы уравнения Лангмюра равны: Г∞ ==9.10-6 моль/м2, в==7 л/моль. Вычислите величины адсорбции при с=0-0,1-0,4-1,6-3,2 моль/л и постройте график.
123. Из набора адсорбентов (активированный уголь, силикагель, каолин) подберите лучший адсорбент для извлечения анилина из водного раствора, если значения диэлектрической проницаемости анилина – 7,1, воды – 80,1. Ответ поясните.
124. Чем определяется поверхностная активность молекул ПАВ? Привести примеры поверхностно-активных и поверхностно-инактивных веществ. Из какого растворителя будет более полно извлекаться ацетон каолином: из воды, этилового спирта или бензола, если значения диэлектрической проницаемости воды – 80,1, этанола – 25,0, бензола – 2,3.
125. Чем определяется поверхностная активность молекул карбоновых кислот и как она зависит от их строения. Из набора адсорбентов (активированный уголь, силикагель, каолин) подберите (теоретически) лучший адсорбент для очистки от примесей подсолнечного масла.
126. По уравнению Фрейндлиха вычислите равновесную концентрацию уксусной кислоты, если 1 г угля адсорбирует 3,76 ммоль уксусной кислоты СН3СООН, k = 2,82; n = 2,44.
127. Определите величину адсорбции при 10о С для водного раствора, содержащего 100 мг / л уксусной кислоты, если поверхностное натяжение раствора 57,4·10-3 Н / м. Поверхностное натяжение воды – 73,05·10-3 Н / м.
128. Константы уравнения Лангмюра равны:
Г∞ == 0,7-10-6 моль/м2, в=4 л/моль. Вычислите величины адсорбции при с=0-0,1-0,5-1,6-3,2 моль/л и постройте график.
ТЕМЫ YIІ- YIІІ.
129-140. Коллоидный раствор получен в результате реакции обмена при смешивании равных объемов растворов А и Б разных концентраций. Напишите и объясните формулу мицеллы золя и схему ее строения. Определите, какой из двух электролитов будет иметь меньший порог коагуляции для полученного золя.
| Номер задачи | Раствор А | Раствор В | Электролиты |
| 129 | 0,005 н АgNОз | 0,0001 н КС1 | Ва(NОз)2; К2SО4 |
| 130 | 0,002 н Н2S | 0,0001н Вi(ОН)з | Ва(NОз)2; К2SО4 |
| 131 | 0,09 н Ва(ОН)2 | 0,05 н Н2SO4 | К2SО4; ВаСI2 |
| 132 | 0,005 н Н2SO4 | 0,003 н Ва(ОН)2 | А1(ОН)з; КС1 |
| 133 | 0,008 н АgNОз | 0,004 н НВг | Nа2 SО4.; А1С1з |
| 134 | 0,004 н АgNОз | 0,008 н НВг | Ва(NОз)2; К2SO4 |
| 135 | 0,001 н АuОН | 0,003 н КВг | МgСI2; К2SO4 |
| 136 | 0,005 н Аs(ОН)3 | 0,003 н Н2S | ВаСI2; К2SO4 |
| 137 | 0,005 н Mg(ОН)2 | 0,01 н Н3PO4 | Nа2 SО4; А1С1з |
| 138 | 0,01 н Mg(ОН)2 | 0,005 н НзРO4 | Nа2 SО4; А1С1з |
| 139 | 0,0007 н AgNO3 | 0,0001 н КВг | Ва(NОз)2; К2SO4 |
| 140 | 0,007 н Н2S | 0,002 н Вi(ОН)з | К2SO4; ВаС12 |
141. Что такое полуколлоиды? Приведите примеры. Золь хлорида серебра получен смешением равных объемов 0,0095 н КСl и 0,012 н АgNО3. Какой из электролитов: К3[Fе(СN)6], К4[Fе(СN)6] или MgSО4 будет обладать наименьшей коагулирующей способностью?
142. Как построены мицеллы олеата натрия и какие происходят изменения в их строении с увеличением концентрации раствора мыла? К 100 см 3 0,003%-ного раствора хлорида натрия добавлено 250 см 3 0,001 н. раствора АgNО3. Для получения коагуляции к полученному золю хлорида серебра добавлены следующие электролиты: КВr, Ва(NО3)2, К2СrО4, MgSO4, АlСl3. Какой из добавленных электролитов имеет наименьший порог коагуляции, а какой – наименьшую коагулирующую способность?
143. Почему растворы полуколлоидов являются полидисперсными системами? Какой объем 0,005 н раствора азотнокислого серебра нужно прибавить к 25 см 3 0,0016 н раствора КСl, чтобы получить отрицательный золь хлористого серебра? Напишите строение мицеллы золя.
144. Чем объясняется способность полуколлоидов хорошо стабилизировать системы с полярной и неполярной дисперсными фазами? Золь гидроксида железа (III) получен при добавлении к 85 см 3 кипящей дистиллированной воды 15 см 3 2%-ного раствора FeCl3. Напишите возможные формулы мицелл золя Fe(OH)3, учитывая, что при образовании частиц гидрозоля в растворе присутствовали следующие ионы: Fe3+, FeO+, H+, Cl–. Определите направление движения частиц каждого из золей при электрофорезе.
145. Из каких коллоидных процессов складывается механизм моющего действия мыл? При пептизации оловянной кислоты соляной кислотой частично идет реакция Н2SnO3 + 2НС1 → SnОСl2 + 2Н2O. Образующийся оксихлорид олова диссоциирует по уравнению SnОС12 ↔ SnО2+ + 2Сl–. Электрофорезом установлено, что гранулы золя оловянной кислоты перемещаются к отрицательному полюсу. Дайте схему строения мицеллы оловянной кислоты.
146. Что такое солюбилизация и где это явление применяется? Какие объемы 0,029%-ного раствора NaCl и 0,001 н AgNO3 надо смешать, чтобы получить незаряженные частицы золя AgCl? Плотность раствора NaCl принять равной единице.
147. Даны порошки, состоящие из частиц крахмала, муки, полиэтилена, графита. Объясните, какие из этих порошков могут образовывать агрегативно устойчивые суспензии в воде и бензине? Найдите скорость оседания частиц суспензии какао в воде при 288 К. Радиус частиц 2·10–6 м, плотность какао 2,2·103 кг / м 3, вязкость воды 1,14·10–3 Па · с.
148. Что такое суспензия? Приведите примеры суспензий продовольственных и промышленных товаров. Рассчитайте скорость оседания в воде сферических частиц суспензии при 298 К, если радиус частиц 2·10–5 м, плотность их 2,2·103 кг / м 3, плотность среды 1,15·103 кг / м 3, вязкость воды 1·10–3 Па · с.
149. Что такое эмульсия? Как определяют тип эмульсии? Приведите примеры эмульсий непродовольственных или продовольственных товаров. Вычислите средний сдвиг частиц эмульсии с радиусом 6,5·10–5 м за 1 с. Вязкость среды 10–3 Па · с, температура 288 К.
150. Какую эмульсию будет стабилизировать сажа: эмульсию бензола в воде или воды в бензоле. Объясните и покажите на схеме механизм стабилизации.
151. Что такое пена? Приведите примеры жидких и твердых пен. Вычислите коэффициент диффузии частиц высокодисперсного аэрозоля с радиусом частиц 2·10–8 м при 293 К. Вязкость воздуха 1,8·10–5 Па · с.
152. Какого типа образуется эмульсия из воды и оливкового масла при использовании в качестве эмульгатора яичного белка? Ответ объяснить и показать на схеме.
153. Как классифицируются полимеры по составу основной цепи? Напишите схему формулы поливинилхлорида, полиэтилен-тетрафталата и укажите, к какому классу они относятся.
154. Укажите, какие факторы определяют гибкость цепи полимера. Какой из трех полимеров: резина, полиэтилен и поливинилхлорид - будет обладать большей гибкостью макромолекулы? Почему?
155. Какие агрегатные (физические) состояния характерны для аморфных полимеров? В каком агрегатном состоянии будет находиться полистирол при -4-20°С и при -20°С?
156. Какими свойствами обладают полимеры в стеклообразном и высокоэластичном состоянии? Желатин помещен в буферный раствор с рН 3. Определите знак заряда частиц желатина, если изоэлектрическая точка его находится при рН 4,7.
157. Объясните, почему резина набухает в бензоле ограниченно, а каучук неограниченно? Что такое избирательность процесса набухания? При набухании 100 г каучука поглотилось 964 мл хлороформа. Рассчитайте процентный состав полученного студня. Плотность СНСl3 равна 1,9 г/см3.
158. Почему растворы полимеров относятся к истинным растворам? Образец вулканизованного каучука объемом 11,2 см 3 за 5 ч выдержки в тетрахлорметане увеличился до 51,3 см 3. Рассчитайте степень набухания этого материала. К какому типу относится это набухание, если при дальнейшем стоянии образца его объем не изменяется?
159. Даны следующ
 2020-01-14
2020-01-14 785
785







