В дисперсных системах типа Т/Ж (коллоидные растворы и суспензии) на границе раздела фаз самопроизвольно возникает избыточный электрический заряд, что приводит к формированию на поверхности твердой дисперсной фазы двойного электрического слоя (ДЭС).
Электрически нейтральную коллоидную частицу называют мицеллой. Мицелла – это структурная коллоидная единица, она способна к самостоятельному существованию и определяет все основные свойства коллоидной системы.
Схема строения ДЭС представлена на рис.6.
 |
| Рис.6. Строение двойного электрического слоя. |
Мицелла лиофобного золя представляет собой кристаллик дисперсной фазы с окружающим его двойным электрическим слоем. Твердая фаза, которая находится в середине мицеллы называется агрегатом, агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы; ядро вместе с адсорбционным слоем противоинов образует частицу или гранулу, которая окружена диффузным слоем противоинов.
Состав мицелл выражают формулами. Рассмотрим, как составляется такая формула на примере мицеллы золя AgI, образованного в результате взаимодействия растворенных веществ
AgNO3 + KI = AgI + KNO3.
В данном случае дисперсная фаза состоит из молекул AgI. На поверхности твердой фазы, согласно правилу Панета-Фаянса, будут преимущественно адсорбироваться те ионы, которые способны достраивать кристаллическую решетку твердой частицы. Если в системе содержится в избытке KI, то такими ионами являются йодид-ионы I–, которые составят потенциалобразующий слой, а катионы К+ будут формировать адсорбционный и диффузный слои противоинов. Условно мицелла запишется формулой:
 ,
,
где m – количество молекул в ядре частицы; n – количество потенциалопределяющих ионов; (n-x) – количество противоинов в адсорбционном слое; х – количество противоинов в диффузном слое.
На Рис.7. приведена схема строения мицеллы золя AgI (а) и ее формула (б).
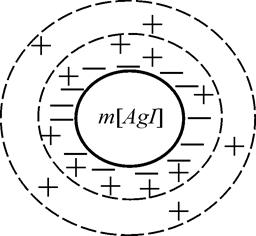 |  |
| Рис.7. Схема строения (а) и формула мицеллы йодида серебра (б).
| |
Если потенциалопределяющие ионы 2-х, 3-х и более зарядные, то число адсорбционных противоионов будет 2 (n-x), 3 (n-x) и т.д. и заряд гранулы будет равен 2х, 3х с соответствующим знаком. например, формула мицеллы Fе(ОН)3, образованной в присутствии избытка FеСl3, запишется таким образом:
 .
.
При движении частицы ДЭС разрывается. Место разрыва при перемещении твердой и жидкой фаз относительно друг друга называется плоскостью скольжения или границей скольжения (см. Рис.6). Потенциал на плоскости скольжения называется электрокинетическим или дзета-потенциалом (ζ).
ζ-потенциал является важнейшей характеристикой ДЭС: он определяет скорость относительного перемещения дисперсной фазы и дисперсионной среды, устойчивость золей, интенсивность электрокинетических явлений и др. Чем больше ζ-потенциал, тем больше силы электростатического отталкивания между коллоидными частицами, и тем выше устойчивость коллоидной системы в целом. Когда ζ-потенциал равен нулю, система находится в изоэлектрическом состоянии: в этом случае коллоидные частицы сближаются до такого расстояния, когда силы молекулярного сцепления больше сил электростатического отталкивания и частицы начинают слипаться и выделяться из раствора.
Электрофорез – движение частиц дисперсной фазы в неподвижной дисперсионной среде под действием внешнего электрического поля. Скорость электрофореза u 0 зав-т от величины ζ-потенциала и определяется по формуле:
 , м / с,
, м / с,
где η – вязкость дисперсионной среды; ζ – дзета-потенциал; Е – напряженность или градиент электрического поля; ε – диэлектрическая проницаемость среды; ε0 – абсолютная диэлектрическая проницаемость (8,85·10–12 Ф / м).
Электроосмос – движение дисперсионной среды под действием внешнего электрического поля. Скорость электроосмоса равна:
 , м / с,
, м / с,
κ – удельная электрическая проводимость золя; I – сила тока.
 2020-01-14
2020-01-14 932
932








