Кинетическая схема гетерогенного процесса:
1. Доставка газа–окислителя к поверхности раздела фаз (внешняя диффузия);
2. Адсорбция газа–окислителя на поверхности углерода;
3. Химическое взаимодействие с образованием адсорбированных продуктов;
4. Десорбция продуктов;
5. Диффузия (отвод) продуктов от поверхности в газовый поток.
Стадии 1 и 5 переноса компонентов газовой фазы в реальной металлургической системе всегда связаны с конвективными турбулентными макропотоками. Это диффузия в потоке – массопередача.
Стадии 2, 3 и 4 – химические (адсорбционно–химические).
Медленная стадия – лимитирующая.
Режимы процесса:
– диффузионный;
– кинетический (химический);
– переходный (смешанный).
Основные закономерности диффузии в потоке
Скорость диффузии

где 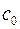 – концентрация газа–окислителя в объеме (ядре потока);
– концентрация газа–окислителя в объеме (ядре потока);  – концентрация газа–окислителя на поверхности твердого углерода;
– концентрация газа–окислителя на поверхности твердого углерода; 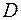 – константа диффузии;
– константа диффузии;  – толщина диффузионного слоя;
– толщина диффузионного слоя;  – коэффициент массопереноса.
– коэффициент массопереноса.

 ,
,
где W – cкорость газового потока; d – размер (приведенный диаметр) куска угля; n – показатель, зависящий от условий.
 – формула Эйнштейна.
– формула Эйнштейна.
Здесь  – число Авогадро; r – радиус диффундирующих частиц;
– число Авогадро; r – радиус диффундирующих частиц;  – коэффициент динамической вязкости газа.
– коэффициент динамической вязкости газа.
 ,
,
где А – коэффициент пропорциональности; m = 1,7 для реальных газов.
Факторы, влияющие на скорость диффузии газов в потоке:
1. Скорость газового потока, W;
2. Природа и свойства газа, r,  , D;
, D;
3. Размер частиц углерода, d;
4. Температура, Т.
Рассмотрим упрощенную схему, полагая, что горение определяется двумя стадиями – доставкой кислорода к месту реакции и химическим взаимодействием на поверхности. Величина диффузионного потока кислорода (скорость диффузии) из объема газа к единице поверхности углерода согласно первому закону Фика
 (1)
(1)
где d – толщина диффузионного слоя;  и
и  – концентрации кислорода в объеме газа и на поверхности углерода,
– концентрации кислорода в объеме газа и на поверхности углерода, 
Пусть химическая реакция имеет I порядок.
Тогда скорость ее
 (2а)
(2а)
где  – константа скорости реакции.
– константа скорости реакции.
При установившейся режиме скорости последовательных звеньев и наблюдаемая скорость суммарного превращения  одинаковы,
одинаковы, 
Тогда 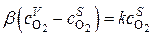
и 
 (*)
(*)
Уравнение справедливо для смешанного режима.
Для диффузионного режима  и
и  (2)
(2)
Для кинетического режима  и
и 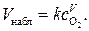 (3)
(3)
Несмотря на сходство уравнений (2) и (3), они описывают разный характер протекания процесса.
Уравнение (*) нередко записывают через «эффективную» константу скорости гетерогенного процесса К

Здесь 
Это выражение можно привести к виду:  и трактовать так:
и трактовать так:
«полное сопротивление протеканию процесса складывается из суммы химического и диффузионного сопротивлений».
 2020-01-14
2020-01-14 222
222








