Рассмотрим реакции диссоциации карбонатов  ,
,  ,
, 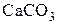 ,
,  , и
, и 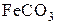
Запишем уравнение диссоциации карбоната кальция с учетом, что 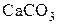 и
и  представляют две самостоятельные фазы (чистые вещества)
представляют две самостоятельные фазы (чистые вещества)
 (2)
(2)
К анализу применим указанные ранее положения для систем без растворов.
Из справочной литературы для реакции образования  из оксидов:
из оксидов:
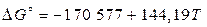 , Дж/моль, (973…1473 К).
, Дж/моль, (973…1473 К).
Тогда
 .
.
Отсюда

С помощью найденного уравнения температурной зависимости упругости диссоциации карбоната  вычислим значения
вычислим значения  в интервале температур 950–1200 К (табл. 1) и построим график (рис. 1).
в интервале температур 950–1200 К (табл. 1) и построим график (рис. 1).
Таблица 1
Упругость диссоциации карбоната 
| T, К | 950 | 1000 | 1050 | 1100 | 1150 | 1200 |
 , атм , атм | 0,014 | 0,042 | 0,111 | 0,270 | 0,607 | 1,278 |
 , мм рт. ст. , мм рт. ст. | 11 | 32 | 84 | 205 | 462 | 972 |
 Представленная на рис..1 кривая характеризует равновесные состояния в системе. Состояния, соответствующие фигуративным точкам вне данной линии, являются неравновесными. В этих условиях должен идти процесс либо диссоциации, либо ассоциации
Представленная на рис..1 кривая характеризует равновесные состояния в системе. Состояния, соответствующие фигуративным точкам вне данной линии, являются неравновесными. В этих условиях должен идти процесс либо диссоциации, либо ассоциации  .
.
Направление процесса можно найти, используя уравнение изотермы химической реакции
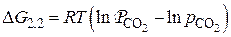 ,
,
где  – фактическое давление
– фактическое давление  в атмосфере над карбонатом.
в атмосфере над карбонатом.
Из данного уравнения следует, что возможность протекания процесса диссоциации при температуре T ( ) определяется условием
) определяется условием  , то есть когда упругость диссоциации карбоната
, то есть когда упругость диссоциации карбоната 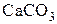 оказывается больше фактического давления
оказывается больше фактического давления  в газовой атмосфере над карбонатом. Этому условию на графике отвечают состояния, соответствующие точкам под кривой, например, точке а. Область ниже кривой равновесия – область неустойчивых состояний
в газовой атмосфере над карбонатом. Этому условию на графике отвечают состояния, соответствующие точкам под кривой, например, точке а. Область ниже кривой равновесия – область неустойчивых состояний  и устойчивых состояний оксида
и устойчивых состояний оксида  . Напротив, точки в области выше кривой равновесия (например, точка b) отражают условия
. Напротив, точки в области выше кривой равновесия (например, точка b) отражают условия 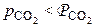 и
и  , когда диссоциация
, когда диссоциация  невозможна. Это область устойчивости карбоната. Температура, при которой
невозможна. Это область устойчивости карбоната. Температура, при которой  и
и  , называется температурой начала диссоциации карбоната
, называется температурой начала диссоциации карбоната  . Ее значение можно найти, подставляя фактическое давление
. Ее значение можно найти, подставляя фактическое давление  вместо равновесного
вместо равновесного 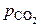 в выражение температурной зависимости упругости диссоциации карбоната.
в выражение температурной зависимости упругости диссоциации карбоната.
В реакторе
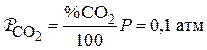 .
.
Тогда
 .
.
Согласно термодинамическому условию диссоциации процесс должен начаться при незначительном перегреве карбоната выше  . Однако, из-за кинетических затруднений скорость процесса в этом случае будет весьма малой. При прочих равных условиях скорость диссоциации определяется движущей силой
. Однако, из-за кинетических затруднений скорость процесса в этом случае будет весьма малой. При прочих равных условиях скорость диссоциации определяется движущей силой  , которая сильно возрастает по мере перегрева
, которая сильно возрастает по мере перегрева  Процесс диссоциации будет протекать с большой скоростью при температурах выше температуры химического кипения
Процесс диссоциации будет протекать с большой скоростью при температурах выше температуры химического кипения  , при которой упругость диссоциации становится равной общему внешнему давлению газовой фазы. Температура химического кипения
, при которой упругость диссоциации становится равной общему внешнему давлению газовой фазы. Температура химического кипения  при нормальном давлении
при нормальном давлении  = 1 атм вычисляется из условия
= 1 атм вычисляется из условия 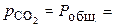 1 атм и для карбоната кальция она составляет
1 атм и для карбоната кальция она составляет
 .
.
Запишем уравнения диссоциации карбонатов с учетом, что карбонат и его оксид представляют две самостоятельные фазы (чистые вещества)
 (3)
(3)
 (4)
(4)
 (5)
(5)
 (6)
(6)
Значения упругости диссоциации карбонатов  приведены в табл. 2 и представлены графически (рис. 2).
приведены в табл. 2 и представлены графически (рис. 2).
Таблица 2
Упругости диссоциации карбонатов  , атм
, атм
| Карбонат | T,К | ||||||||||
| 600 | 700 | 800 | 900 | 1000 | 1100 | 1200 | 1300 | 1400 | 1500 | 1600 | |
 | 0,10 | 2,06 | 19,2 | ||||||||
 | 0,01 | 0,11 | 0,68 | 3,02 | |||||||
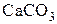 | 0,04 | 0,27 | 1,28 | 4,77 | |||||||
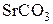 | 0,01 | 0,06 | 0,25 | 0,84 | 2,46 | ||||||
 | 0,004 | 0,02 | 0,09 | 0,32 | |||||||
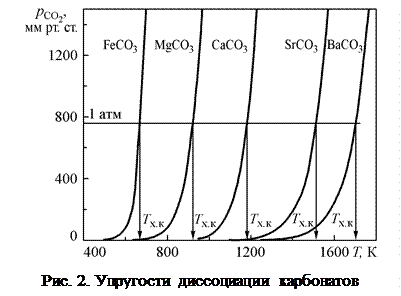 Нормальные температуры химического кипения карбонатов равны 673 К для
Нормальные температуры химического кипения карбонатов равны 673 К для  ; 923 К для
; 923 К для 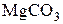 ; 1183 К для
; 1183 К для 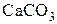 ; 1516К для
; 1516К для  и 1703К для
и 1703К для  . Следовательно, в данной последовательности увеличивается термодинамическая устойчивость карбонатов. Этот же вывод следует из анализа графика.
. Следовательно, в данной последовательности увеличивается термодинамическая устойчивость карбонатов. Этот же вывод следует из анализа графика.
Следует отметить, что диссоциация карбоната железа протекает по уравнению реакции (6) только в условиях интенсивного отвода  от зоны реакции (в вакууме). В противном случае может идти заметное окисление
от зоны реакции (в вакууме). В противном случае может идти заметное окисление  до
до  с образованием
с образованием  . Тогда суммарная реакция диссоциации запишется в виде
. Тогда суммарная реакция диссоциации запишется в виде


 2020-01-14
2020-01-14 1147
1147








