Известнытри устойчивыхоксида железа Fe2O3, Fe3O4, FeO
Запишем уравнения диссоциации оксидов в системах с присутствием оксидов в виде самостоятельных фаз.
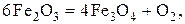 (9)
(9)
 (10)
(10)
 (11)
(11)
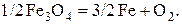 (12)
(12)
Для данного случая (оксиды – самостоятельные фазы) константы равновесия реакций диссоциации 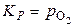 .
.
Данные по упругости диссоциации оксидов железа приведены в табл. 4 и представлены графически (рис. 4). Следует отметить, что в строке таблицы для оксида  представлены результаты расчета двух равновесий
представлены результаты расчета двух равновесий  и
и 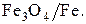 Это обусловлено тем, что оксид
Это обусловлено тем, что оксид  устойчив при температурах только выше 843 К.
устойчив при температурах только выше 843 К.
Таблица 4
Упругости диссоциации оксидов железа 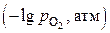
| T, К | 600 | 700 | 800 | 843 | 900 | 1000 | 1100 | 1200 | 1300 | 1400 | 1500 | 1600 |
 | 33,4 | 26 | 20,6 | 18,6 | 16,3 | 12,9 | 10,1 | 7,8 | 5,8 | 4,1 | 2,7 | 1,4 |
 | 39,3 | 32,5 | 27,4 | 25,6 | 23,6 | 19,9 | 16,9 | 14,4 | 12,2 | 10,4 | 8,8 | 7,4 |
 | – | – | – | 25,6 | 23,6 | 20,6 | 18,2 | 16,6 | 14,3 | 12,8 | 11,6 | 10,4 |
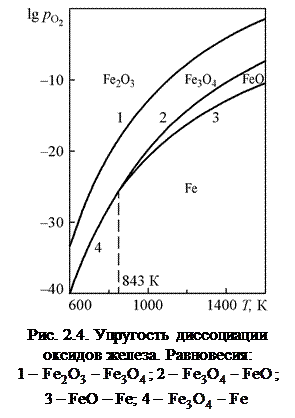 На рис. 4 представлены кривые, характеризующие равновесные состояния четырех систем. Даны обозначения областей устойчивого состояния фаз с кислородом.
На рис. 4 представлены кривые, характеризующие равновесные состояния четырех систем. Даны обозначения областей устойчивого состояния фаз с кислородом.
Для доказательства устойчивого существования оксида в состояниях соответствующей области можно определить направление реакций диссоциации, используя уравнение изотермы
 ,
,
где  – фактическое давление
– фактическое давление 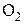 в газовой атмосфере над оксидом;
в газовой атмосфере над оксидом;  – упругость диссоциации оксида.
– упругость диссоциации оксида.
Так для состояний в области выше равновесной кривой 1 справедливо неравенство  для всех оксидов железа. Следовательно, для всех реакций (9)–(12), как следует из уравнения изотермы, изменение энергии
для всех оксидов железа. Следовательно, для всех реакций (9)–(12), как следует из уравнения изотермы, изменение энергии  . Это означает, что все реакции должны протекать в обратном направлении и процессы должны завершиться образованием
. Это означает, что все реакции должны протекать в обратном направлении и процессы должны завершиться образованием  Напротив, для состояний в области ниже равновесных кривых 3 и 4 для всех оксидов железа выполняется термодинамическое условие диссоциации
Напротив, для состояний в области ниже равновесных кривых 3 и 4 для всех оксидов железа выполняется термодинамическое условие диссоциации 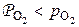 , и разложение их должно привести к образованию
, и разложение их должно привести к образованию  как устойчивого продукта.
как устойчивого продукта.
Аналогично можно показать, что состояния областей, ограниченных кривыми 1, 4 и 2, а также линиями 2 и 3, отвечают направлению реакций, завершающихся образованием  и
и  .
.
Рис. 4 может быть назван диаграммой устойчивости железа и его оксидов в системе 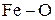 . Из диаграммы видно, что для получения
. Из диаграммы видно, что для получения 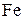 путем термической диссоциации нужно в газовой фазе иметь давления кислорода меньше 10–40…10–10 атм.
путем термической диссоциации нужно в газовой фазе иметь давления кислорода меньше 10–40…10–10 атм.
Влияние фазовых превращений на температурную зависимость
упругости диссоциации соединений
При температурах фазовых превращений соединений  и
и  (кристаллохимических и агрегатных) происходят изменения зависимости упругости диссоциации соединений от температуры. Это связано с наличием теплот превращений и соответственно со скачкообразным изменением тепловых эффектов реакций диссоциации соединений.
(кристаллохимических и агрегатных) происходят изменения зависимости упругости диссоциации соединений от температуры. Это связано с наличием теплот превращений и соответственно со скачкообразным изменением тепловых эффектов реакций диссоциации соединений.
В соответствии с уравнением

величина упругости диссоциации соединений связана с тепловым эффектом реакции диссоциации. Если при фазовом переходе значение  увеличивается, то чем больше скачок
увеличивается, то чем больше скачок  , тем больше величина производной и тем сильнее возрастает крутизна температурной зависимости упругости диссоциации соединения
, тем больше величина производной и тем сильнее возрастает крутизна температурной зависимости упругости диссоциации соединения  при переходе через точку фазового превращения. Это характерно для процессов плавления, испарения и возгонки продукта диссоциации
при переходе через точку фазового превращения. Это характерно для процессов плавления, испарения и возгонки продукта диссоциации  . Для этих же агрегатных превращений исходного соединения
. Для этих же агрегатных превращений исходного соединения  значение
значение  уменьшается, и крутизна температурной зависимости упругости диссоциации соединения
уменьшается, и крутизна температурной зависимости упругости диссоциации соединения  также уменьшается.
также уменьшается.
Следовательно, уравнения зависимости упругости диссоциации соединения  от температуры оказываются справедливыми только в интервалах, ограниченных точками фазовых переходов. Эти интервалы представлены в таблицах энергий Гиббса образования соединений, однако, не для всех веществ. В последнем случае влияние фазовых превращений можно оценить, используя данные о теплотах и температурах превращений.
от температуры оказываются справедливыми только в интервалах, ограниченных точками фазовых переходов. Эти интервалы представлены в таблицах энергий Гиббса образования соединений, однако, не для всех веществ. В последнем случае влияние фазовых превращений можно оценить, используя данные о теплотах и температурах превращений.
В качестве примера рассмотрим влияние фазовых переходов на температурную зависимость энергии образования оксида кальция.
На рис. 5 представлены температурные зависимости энергий образования оксида кальция с разными агрегатными состояниями реагентов.
 (19)
(19)
 (17)
(17)
 (21)
(21)
 Видно, что в точках фазовых превращений температурная зависимость энергии образования оксида кальция имеет изломы.
Видно, что в точках фазовых превращений температурная зависимость энергии образования оксида кальция имеет изломы.
. При этом наиболее значительное изменение уравнения зависимости  от температуры вызывает переход металла в газообразное состояние. Уравнения температурной зависимости упругости диссоциации оксида кальция в разных интервалах оказываются также неодинаковыми, вследствие чего кривая
от температуры вызывает переход металла в газообразное состояние. Уравнения температурной зависимости упругости диссоциации оксида кальция в разных интервалах оказываются также неодинаковыми, вследствие чего кривая 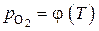 должна иметь изломы в точках фазовых превращений.
должна иметь изломы в точках фазовых превращений.
Сравнительная характеристика устойчивости оксидов металлов
Упругость диссоциации оксида позволяет оценить кислородный потенциал системы металл – оксид. Кислородный потенциал оксидной системы имеет те же обозначения (в нижних индексах), что и упругость диссоциации оксида и по определению  . Для систем с реагентами, находящимися в стандартных состояниях, кислородный потенциал численно равен стандартному изменению энергии Гиббса для реакции образования оксида
. Для систем с реагентами, находящимися в стандартных состояниях, кислородный потенциал численно равен стандартному изменению энергии Гиббса для реакции образования оксида  в расчете на 1 моль
в расчете на 1 моль 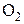 в системе. Это позволяет сопоставлять указанные характеристики различных металлооксидных систем на одной диаграмме (рис. 6). Используя ее, можно легко сравнить устойчивость различных оксидов: чем ниже располагается линия для
в системе. Это позволяет сопоставлять указанные характеристики различных металлооксидных систем на одной диаграмме (рис. 6). Используя ее, можно легко сравнить устойчивость различных оксидов: чем ниже располагается линия для 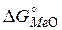 на диаграмме, тем более устойчивым является данный оксид.
на диаграмме, тем более устойчивым является данный оксид.

Рис. 6. Зависимость стандартного изменения энергии Гиббса
от температуры для реакций образования оксидов металлов
В соответствии с теоретическими положениями о влиянии фазовых превращений на термодинамическую устойчивость оксидов линии  на диаграмме оказываются ломаными в точках фазовых переходов. Точки изломов отмечены для металлов: п – плавление, к – кипение, т – полиморфное превращение; для оксидов металлов: по – плавление, то – полиморфное превращение.
на диаграмме оказываются ломаными в точках фазовых переходов. Точки изломов отмечены для металлов: п – плавление, к – кипение, т – полиморфное превращение; для оксидов металлов: по – плавление, то – полиморфное превращение.
Диаграмма, по сути, представляет сочетание нескольких диаграмм, отображающих зависимости  или
или  в системах
в системах  ,
,  и
и  . Дополнительные шкалы на диаграмме связаны с соответствующими указанным системам точками О, Н и С, расположенными на ординате графика. Это те же точки, что показаны на рис. 12 и 13 раздела «Процессы горения, состав и свойства высокотемпературной газовой атмосферы металлургических агрегатов»
. Дополнительные шкалы на диаграмме связаны с соответствующими указанным системам точками О, Н и С, расположенными на ординате графика. Это те же точки, что показаны на рис. 12 и 13 раздела «Процессы горения, состав и свойства высокотемпературной газовой атмосферы металлургических агрегатов»
По диаграмме можно определить условия окисления чистого металла газовой фазой с заданным парциальным давлением кислорода. Для этого соединяют точку О на диаграмме с точкой на линии 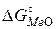 для реакции образования оксида при заданной температуре. Соответствующее равновесное давление кислорода (упругость диссоциации оксида) находим на продолжении этой прямой на шкале
для реакции образования оксида при заданной температуре. Соответствующее равновесное давление кислорода (упругость диссоциации оксида) находим на продолжении этой прямой на шкале  . Диаграмма позволяет также определить условия окисления чистого металла газовыми смесями СО – СО2 или
. Диаграмма позволяет также определить условия окисления чистого металла газовыми смесями СО – СО2 или  с заданным отношением
с заданным отношением  или
или  . Соединяя точки Си Н на ординате нулевого значения температуры с соответствующими значениями отношения
. Соединяя точки Си Н на ординате нулевого значения температуры с соответствующими значениями отношения 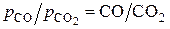 или
или  на дополнительных шкалах, получаем линии для
на дополнительных шкалах, получаем линии для  и
и  , показанные на рис. 12 и 13. Далее сопоставляем значения кислородных потенциалов газовых смесей и
, показанные на рис. 12 и 13. Далее сопоставляем значения кислородных потенциалов газовых смесей и 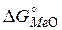 соответствующих оксидов металлов при рассматриваемой температуре. Газовая фаза будет окислительной по отношению к металлу, если кислородный потенциал газовой фазы будет больше, чем кислородный потенциал или
соответствующих оксидов металлов при рассматриваемой температуре. Газовая фаза будет окислительной по отношению к металлу, если кислородный потенциал газовой фазы будет больше, чем кислородный потенциал или 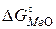 оксида данного металла
оксида данного металла
 .
.
 2020-01-14
2020-01-14 1015
1015








