Жидкие стали, чугун и ферросплавы являются реальными растворами, так как растворенные в них элементы достаточно сильно взаимодействуют друг с другом. Мерой характера и сил их взаимодействия могут служить активности и коэффициенты активности компонентов раствора. Знание их позволяет определять термодинамические условия протекания важнейших реакций взаимодействия между элементами расплавов и компонентами газовой и шлаковой фаз. Результатом таких реакций является образование оксидов, сульфидов, нитридов, растворов водорода и других примесей в железе.
Термодинамический анализ указанных реакций позволяет рассчитать равновесные содержания примесей в железе. Для ряда реакций можно провести такие расчеты без привлечения данных об активностях компонентов шлаковых расплавов.
К таким расчетам относится определение концентраций кислорода, серы, азота и водорода в сталях и чугунах, повышенные содержания которых в сплавах приводят к ухудшению ряда важнейших технологических свойств металла (прочности, пластичности и др.).
Рассмотрим методику таких расчетов на некоторых примерах.
Взаимодействие углерода с кислородом.
Реакция взаимодействия между растворенными в металле углеродом и кислородом, является ведущей в процессах окислительного рафинирования и раскисления жидкой стали. При пониженных давлениях получения и обработки стали углерод является наиболее эффективным раскислителем.
Пример 1. Железо, содержащее по данным анализа металла 0,2 % С и 0,08 % О, расплавляется и выдерживается при 1875 К в атмосфере СО под давлением 0,45 атм.
Определить направление самопроизвольного процесса и равновесные концентрации кислорода и углерода в металле.
Решение.
Уравнение р еакции взаимодействия углерода с кислородом в металле
[C]+[O] = CO (1)
Константа равновесия реакции:
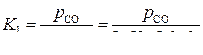 (2)
(2)
Здесь в качестве стандартных состояний кислорода и углерода в металле выбраны состояния их в 1-%-ном идеальном растворе.
Направление самопроизвольного протекания реакции определим с помощью уравнения изотермы по знаку изменения энергии Гиббса реакции:
 (3)
(3)
Здесь  и
и  – активности, соответствующие исходным концентрациям С и О.
– активности, соответствующие исходным концентрациям С и О.
Значение стандартного изменения энергии Гиббса реакции находим, представляя уравнение реакции (1) в виде алгебраической суммы уравнений трех реакций:
С + 1/2O2 = CO (4) 
C = [C] (5) 
1/2O2 = [O] (6) 
Из данной комбинации реакций следует:
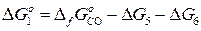 (7)
(7)
По справочным данным для реакции образования СО и реакций растворения углерода и кислорода в жидком железе с образованием 1-%-ного раствора
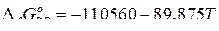 , Дж/моль;
, Дж/моль;
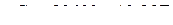 , Дж/моль;
, Дж/моль;
 , Дж/моль
, Дж/моль
находим температурную зависимость: 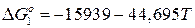 , Дж;
, Дж;  Дж и константу равновесия реакции К 1 =601.
Дж и константу равновесия реакции К 1 =601.
Коэффициенты активности углерода и кислорода в жидком железе находим с помощью параметров взаимодействия по уравнениям:


Для вычисления используем следующие табличные значения параметров взаимодействия при 1873 К.
| Элемент J | 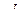
| 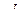
|
| C | 0,14 | –0,45 |
| O | –0,34 | –0,20 |
Получаем  .
.
Тогда  Дж
Дж
Так как  , то самопроизвольно должна идти реакция окисления углерода с образованием СО. В результате этого концентрации кислорода и углерода в металле должны уменьшаться до наступления равновесия при 1875 К и P CO = 0,45 атм.
, то самопроизвольно должна идти реакция окисления углерода с образованием СО. В результате этого концентрации кислорода и углерода в металле должны уменьшаться до наступления равновесия при 1875 К и P CO = 0,45 атм.
Для расчета равновесных концентраций кислорода и углерода в металле запишем следующую схему:
[C] + [O] = CO (1)
исходные конц. %С %О
равновесн. конц. [%С–(12/16) x ] [%О– x ]
Здесь x – количество израсходованного кислорода (% по массе) в расчете на 100 г расплава; (12/16) x – количество окисленного углерода (12/16 – пересчетный коэффициент, учитывающий стехиометрические соотношения в уравнении реакции и молярные массы углерода и кислорода.
Введя указанные в схеме концентрации кислорода и углерода в металле в выражение (2) константы равновесия реакции (1), получим:
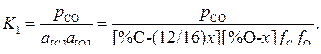
Отсюда 
Решение данного квадратичного уравнения дает значение х = 0,0734 %(мас.)
Тогда равновесные концентрации кислорода и углерода в металле равны 0,0066% и 0,145 % соответственно.
 2020-01-14
2020-01-14 607
607








