Металлы, как в твердом, так и жидком состояниях поглощают из газовой фазы азот и водород. Большие различия в растворимости этих газов в жидком и твердом сплавах является одной из значимых причин несплошности и пониженных прочностных и пластических свойств металлов.
Источники поступления азота и водорода в сталь:
– атмосферный воздух и газовая атмосфера металлургических агрегатов, содержащие азот, водяные пары и водород;
– шихтовые материалы, содержащие гигроскопическую и гидратную влагу;
– оборудование металлургических агрегатов (желоба, ковши и др.).
Процесс растворения газов в металле состоит из следующих элементарных этапов:
1. Адсорбция газа на поверхности металла.
2. Диссоциация молекул газа на атомы.
3. Собственно растворение или поглощение (окклюзия) атомов газа металлом.
Если теплота адсорбции характеризуется небольшими значениями, то теплоты диссоциации (D Н дисс.>0) и растворения (D Н раств.<0) значительны и их соотношение определяет эндотермический характер процесса растворения газов в расплавленных металлах.
Суммарный процесс растворения газов описывают уравнениями:
½ N2(газ) = [N]  Дж/моль (1)
Дж/моль (1)
½ H2(газ) = [H] 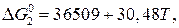 Дж/моль (2)
Дж/моль (2)
Здесь приведены уравнения для  и
и  растворения газов в жидком железе с образованием 1%-ного идеального раствора.
растворения газов в жидком железе с образованием 1%-ного идеального раствора.
Рассматриваемые системы – двухкомпонентные и двухфазные.
Число степеней свободы f = k + 2 – n = 2.
Значит, равновесная концентрация [%N] или [%H] зависит от Т и Р.
Константы равновесия реакций:

Для имеющих место малых концентраций [%N] или [%H] в железе, когда  =1 или
=1 или  =1, выполняется закон квадратного корня – пропорциональности равновесной концентрации
=1, выполняется закон квадратного корня – пропорциональности равновесной концентрации  или
или  (закон Сивертса):
(закон Сивертса): 
Равновесная концентрация газа в металле при парциальном давлении его равном 1 атм называется его растворимостью.
В соответствии с эндотермическим характером процесса растворения газов в металлах растворимость [%N] и [%H] в железе с повышением Т возрастает (за исключением растворимости [%N] в g–Fe (рис. 1).
Растворимость [%N]  в жидком железе при 1600оС равна 0,044% (мас.), а растворимость [%H]
в жидком железе при 1600оС равна 0,044% (мас.), а растворимость [%H]  – 0,0027% (мас.).
– 0,0027% (мас.).
При наличии третьего компонента в Fe влияние его на растворимость газов в растворе можно оценить по параметрам взаимодействия данного компонента с газом, приведенным в таблице.
Снижение коэффициента активности и соответствующее повышение растворимости водорода и азота в железе вызывают Cr, Mn, V, Nb, Ti, Ta. Эти элементы обладают большим химическим сродством к азоту и водороду и образуют с ними прочные нитриды и гидриды MeхNу и MeхHу.
К повышению коэффициента активности и уменьшению растворимости H и N приводит наличие в железе B, С, P, Si. Эти элементы заметно взаимодействуют с Fe.
Элементы Co, Cu, Ni, S весьма слабо влияют на растворимость газов в железе.
| Элемент J | Al | B | C | Co | Cr | Cu | Mn | Mo | N |
 | –0,028 | 0,094 | 0,13 | 0,01 | –0,047 | 0,009 | –0,02 | –0,011 | 0 |
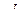 | 0,013 | 0,05 | 0,06 | 0,0018 | –0,0022 | 0,0005 | –0,0014 | 0,0022 | – |
| Элемент J | Nb | Ni | O | P | S | Si | Ti | V | W |
 | –0,086 | 0,01 | 0,05 | 0,045 | 0,007 | 0,047 | –0,78 | –0,093 | –0,0015 |
 | –0,0023 | 0 | –0,19 | 0,011 | 0,008 | 0,027 | –0,019 | –0,0074 | 0,0048 |
Влияние Al, Mo, O, W на растворимость N противоположно влиянию на растворимость Н
При анализе взаимодействия с азотом, растворенным в железе, нитридообразующих элементов необходимо учитывать, что уже при очень низких концентрациях этих элементов (Al, Cr, Mn, V, Nb, Ti, Ta) обеспечивается предельная растворимость N в сплаве и возможно образование нитридных фаз.
Рассмотрим методику определения растворимости газов и условий образования нитридов.
Пример 6. Рассчитать растворимость азота в расплавленной стали следующего состава: 0,12%C, 0,5%Si, 1,5%Mn, 2%Cr, 4%Ni, 1%Mo при 1600оС и давлениях азота в газовой атмосфере 40 кПа и 101 кПа.
Решение.
Растворение азота в стали представляем уравнением
½ N2(газ) = [N]  Дж/моль (1)
Дж/моль (1)
Константа равновесия реакции
 (2)
(2)
равна 
Коэффициент активности азота находим по методу Вагнера.
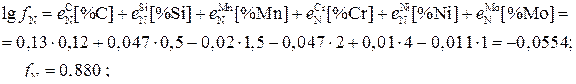
Из выражения (2) находим
Для давления азота 40 кПа 
Для давления азота 101 кПа = 1 атм 
Растворимость [%N] в чистом жидком железе при 1600оС равна 0,044% (мас.).
Значит, наличие в Fe элементов Cr, Mn, Mo, обладающих значительным химическим сродством к азоту, в более повышенных количествах по сравнению с содержаниями С, Si, обладающих значительным химическим сродством к железу, приводит к увеличению растворимости азота.
Пример 7. Рассчитать равновесные концентрации [%Nb] и [%N], при которых возможно образование нитрида Nb2N. Температура 1873К и давление азота в газовой атмосфере  =0,5атм. Коэффициент активности f [Nb]=1. Состав металла: 0,7%C, 0,6%Mn, 0,5%Ni, 0,5%Ce, 0,02%O, x % Nb.
=0,5атм. Коэффициент активности f [Nb]=1. Состав металла: 0,7%C, 0,6%Mn, 0,5%Ni, 0,5%Ce, 0,02%O, x % Nb.
Решение. Реакция образования нитрида:
2[Nb]+[N] =Nb2N (1)
Константа равновесия реакции 
Для расчета константы равновесия комбинируем уравнения реакций, из которых можно получить реакцию образования нитрида из растворенных в железе элементов.
2Nb(ТВ)+½ N2(газ)=Nb2N  Дж/моль (2)
Дж/моль (2)
Nb(ТВ) = [Nb]  Дж/моль (3)
Дж/моль (3)
½ N2(газ) = [N]  Дж/моль (4)
Дж/моль (4)
Из данной комбинации реакций следует:
 (5)
(5)
Находим температурную зависимость:  , Дж;
, Дж;
Отсюда  Дж и K 1 = 0,678
Дж и K 1 = 0,678
Активность азота в расплаве вычисляем из данных по реакции (4).
Константа равновесия реакции 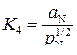 из уравнения
из уравнения 
при 1873 К равна 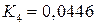 (см. пример 6).
(см. пример 6).
Тогда 
Из выражения  следует
следует 
Так как f [Nb]=1, то 
Коэффициент активности азота записываем через параметры взаимодействия.
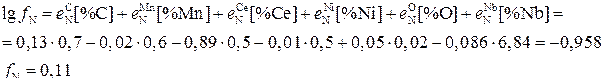
Тогда 
Из-за большого содержания Nb (а также наличия Ce) в расплаве концентрация азота в нем оказалась высокой.
Таким образом, выделение нитридной фазы Nb2N из данного расплава возможно, когда равновесные концентрации [%Nb] и [%N] превышают значения 6,84% и 0,286% соответственно.
Пример 8. Рассчитать растворимость водорода в расплавленной стали следующего состава: 0,8%C, 0,9%Si, 0,3%Mn, 2%Cr, 2%V, 1%Mo и 0,03%О при 1600оС. Расплавленное железо выдерживается в атмосфере аргона, содержащем влагу в количестве 100 г/м3(н.у.)
Решение.
Растворение водорода в стали представляем уравнением
Н2О= [O] + 2[H] (1)
Представим данное уравнение комбинацией следующих трех уравнений:
Н2 + ½ О2 = Н2О(газ) (2) 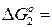 – 246115 + 54,12 Т, Дж
– 246115 + 54,12 Т, Дж
½ O2 = [O] (3)  , Дж
, Дж
½ H2= [H] (4)  Дж
Дж
---------------------------------------------------------------------------
Н2О= [O] + 2[H] (1) = (3)+2∙(4)–(2)
 Дж
Дж
При 1873 К  , Дж
, Дж
Константа равновесия реакции
 (5)
(5)
равна 
Коэффициент активности водорода записываем через параметры взаимодействия.
 Коэффициент активности кислорода
Коэффициент активности кислорода

Парциальное давление водяного пара в аргоне находим следующим образом:
100 г Н2О в 1 м3 аргона соответствуют 100/18=5,6 моль. 1 м3 влажного аргона при нормальных условиях соответствует 1000/22,4=44,6 моль газовой смеси (Ar –Н2О).
Молярная доля Н2О в газовой атмосфере равна 5,6/44,6 = 0,125. При общем давлении смеси 1 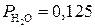 атм.
атм.
Так как растворимость водорода в сплавах на основе Fe весьма мала, то можно считать, что равновесное парциальное давление пара останется практически неизменным, то есть  атм.
атм.
Тогда из выражения (5) получим:
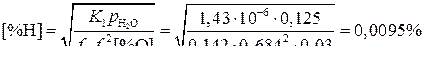
Сравнивая полученное значение 0,0095% с растворимостью  при 1873 К и
при 1873 К и  атм, а при
атм, а при  атм
атм  , следует сделать вывод о значительном увеличении (на порядок) содержания водорода в металле, легированном Cr и V.
, следует сделать вывод о значительном увеличении (на порядок) содержания водорода в металле, легированном Cr и V.
 2020-01-14
2020-01-14 805
805








