Железо и растворенные в нем элементы, как известно, обладают большим химическим сродством к кислороду.
При этом очень мала (10–3– 10–2 %) и небольшая в жидком (0,23% при 16000С и 0,29% при 17000С).
Поэтому при ничтожных парциальных давлениях О2 в газовой фазе (< 10–8 атм) достигается насыщение кислородом расплава с выделением оксидов на поверхности и в объеме металла. Количество и состав оксидов изменяются при охлаждении, что затрудняет анализ процесса. Поэтому концентрации и активности кислорода в железе определяют обычно из данных по равновесию расплава с пароводородной смесью.
Реакции взаимодействия металлического расплава с кислородом, парами воды и диоксидом углерода газовой фазы существенно влияют на полноту и скорость окисления примесей, на насыщенность металла кислородом (и водородом).
На растворимость кислорода в жидком железе оказывают влияние все присутствующие в нем элементы, и следует учитывать взаимное влияние компонентов в расплаве на активность кислорода.
Об эффекте влияния каждого из элементов на коэффициент активности кислорода можно судить по данным о массовых параметрах взаимодействия с кислородом этих элементов в жидком железе при 16000С, приведенным в таблице.
| Элемент J | Al | B | C | Co | Cr | Cu | Mn | Mo | N |
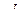
| –3,9 | –2,6 | –0,45 | 0,008 | –0,04 | –0,013 | –0,021 | 0,0035 | 0,057 |
| Элемент J | Nb | Ni | O | P | S | Si | Ti | V | W |
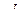
| –0,14 | 0,006 | –0,20 | 0,07 | –0,133 | –0,131 | –0,60 | –0,30 | 0,0085 |
Из таблицы видно, что лишь некоторые элементы (Co, Mo, N, Ni, P) повышают величину коэффициента активности кислорода.
Большинство элементов-примесей железа снижают величину коэффициента активности кислорода, особенно элементы-раскислители, специально вводимые в расплав для связывания и удаления растворенного в нем кислорода как нежелательной (вредной) примеси. Это – Si, V, Al, Ti, B, Ca, Ba, редкоземельные элементы. К ним относится и ряд легирующих элементов: Cr, Nb, Zr и др.
Все эти примеси должны увеличивать концентрацию кислорода в железе с повышением содержания третьего элемента. Уменьшение коэффициента активности соответствует усилению связи кислорода с данным элементом в растворе.
С другой стороны с увеличением концентрации элемента-раскислителя в растворе с б о льшей полнотой идет химическое взаимодействие элемента с кислородом. Это приводит к уменьшению концентрации кислорода в расплаве.
В конечном счете, зависимость равновесной концентрации кислорода от содержания третьего элемента в расплаве оказывается сложной и имеет экстремальный характер (с минимумом по содержанию кислорода).
При этом, чем больше химическое сродство элемента-раскислителя к кислороду, тем ниже минимальная концентрация кислорода в расплаве и тем, как правило, меньше оптимальное содержание раскислителя, соответствующее минимуму [%O].
В реальном случае сложнейшее взаимное влияние большого числа элементов в многокомпонентном сплаве приводит к сложным закономерностям, характеризующим взаимодействия металлического расплава с кислородом.
Пример 2. Расплавленное железо, содержащее 19% Сr, 8% Ni, 0,3% Si и 0,2% Ti, при 1600оС находится в равновесии с газовой фазой Н2– Н2О с отношением 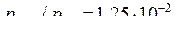 Рассчитайте активность и равновесную концентрацию кислорода в металле.
Рассчитайте активность и равновесную концентрацию кислорода в металле.
Решение.
Записываем уравнение реакции взаимодействия газовой смеси с металлическим расплавом на основе железа, которая приводит к растворению кислорода в сплаве: Н2 + [O] = Н2О (1)
Константа равновесия реакции имеет вид: 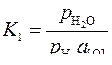
Для определения константы равновесия реакции (1) представим ее как сумму двух реакций
Н2 + ½ О2 = Н2О (2) 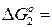 – 246115 + 54,12 Т, Дж
– 246115 + 54,12 Т, Дж
½ O2 = [O] (3) 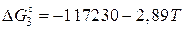 , Дж
, Дж
---------------------------------------------------------------------------
Н2 + [O] = Н2О (1) 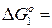 –128885 + 57,01 Т, Дж
–128885 + 57,01 Т, Дж
Зависимость 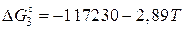 для растворения кислорода в железе взята из справочной литературы.
для растворения кислорода в железе взята из справочной литературы. 
Из выражения 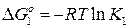 находим значение константы равновесия реакции (1) при 1600оС (1873К). Она равна К 1 = 4,135.
находим значение константы равновесия реакции (1) при 1600оС (1873К). Она равна К 1 = 4,135.
Тогда 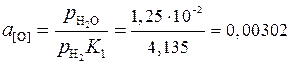 и
и 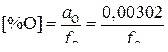 (4)
(4)
По методу параметров взаимодействия
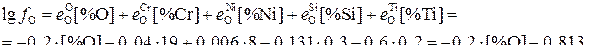 (5)
(5)
Уравнения (4) и (5) образуют систему уравнений с двумя неизвестными.
Обычно при подобных расчетах (без учета возможного образования шлаковой фазы) вычисления упрощают. Содержание кислорода [%O] достаточно мало, поэтому в уравнении (5) первым слагаемым можно пренебречь.
Тогда 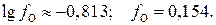
Отсюда 
Проверка полученного значения [%O] путем подстановки его в уравнение (5) дает
малоотличающиеся от ранее вычисленных значения 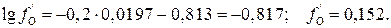
Если применить для более точного расчета метод итераций и считать полученный результат I-м приближением, то, подставив его (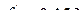 ) в уравнение (4), получим [%O] = 0,198. Полученное значение используем как 2-е приближение. Подставляя его в уравнение (5), получаем
) в уравнение (4), получим [%O] = 0,198. Полученное значение используем как 2-е приближение. Подставляя его в уравнение (5), получаем 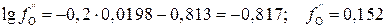 , что совпадает с предыдущим результатом.
, что совпадает с предыдущим результатом.
Таким образом, равновесная концентрация кислорода в металле составляет 0,0198%(мас.), а активность кислорода  относительно стандартного состояния «1%-ный идеальный разбавленный раствор».
относительно стандартного состояния «1%-ный идеальный разбавленный раствор».
Пример 3. Оценить возможность загрязнения железа при плавке его при 16000С в тигле из ZrO2 в атмосфере инертного газа.
Решение.
Возможное частичное растворение материала тигля в железе соответствует реакции
ZrO2 (ТВ) = [Zr] + 2 [O] (1)
Из таблиц «Температурная зависимость констант равновесия реакций взаимодей ствия растворенных в железе элементов», приведенных в литературе по металлургии, выпишем уравнение для константы равновесия реакции (1) в виде
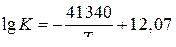 , из которого К 1873 = 9,96∙10–11.
, из которого К 1873 = 9,96∙10–11.
Выражение константы равновесия реакции (1) записываем в идеальной форме для разбавленных растворов:
К = [Zr]∙[O]2 (2)
В соответствии с уравнением реакции растворения соотношение между количествами (моль) кислорода и циркония составляет
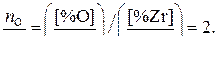
Отсюда 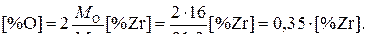 (3)
(3)
Подставляя выражение (3) в (2), получаем:
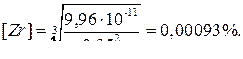
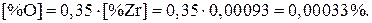
Вычисленные значения равновесных концентраций кислорода и циркония в металле указывают на то, что загрязнения железа при плавке его в тигле из ZrO2 в атмосфере инертного газа практически не происходит.
Можно сделать и другой вывод.
Цирконий (с термодинамических позиций) является эффективным раскислителем, так как даже при очень малых концентрациях его в железе обеспечивается незначительное содержание кислорода в расплаве.
 2020-01-14
2020-01-14 441
441








