1. Ацетон (диметилкетон, систематическое наименование: пропаноон-2) - простейший представитель кетонов. Формула: CH3-C (O) - CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Он полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, жиры, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом. Мировое производство ацетона составляет более 3-х миллионов тонн в год. В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Алкилированием бензолапропеном, окислением полученного кумола до гидропероксида с последующим разложением его на фенол и ацетон.
C6H6+ CH3CH=CH2 → C6H5CH (CH3) 2
C6H5CH (CH3) 2 + O2 → C6H5C (OOH) (CH3) 2
C6H5C (OOH) (CH3) 2 → C6H5OH + OC (CH3) 2
Прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при 50-120°C и 50-100 атм.
CH3CH=CH2 + PdCl2 + H2O → CH3C (O) CH3 + Pd + 2HCl
Pd+2HCl + 0.5O2 → PdCl2 + H2O
Некоторое значение имеет метод брожения крахмала под действием Bacyllus acetobutylicus с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используется также методы получения из изопропилового спирта и ацетилена.
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
CH3C (O) CH3 + NaHSO3 → (CH3) 2C (OH) - SO3Na
Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта.
2CH3C (O) CH3 → (CH3) 2C (OH) CH2C (O) CH3
Восстанавливается цинком до пинакона.
2CH3C (O) CH3 + Zn → (CH3) 2C (OH) C (OH) (CH3) 2
При пиролизе (700°C) образует кетен.
CH3C (O) CH3 → CH2=C=O
Легко присоединяет циановодород с образованием ацетонциангидрина.
CH3C (O) CH3 + HCN → (CH3) 2C (OH) CN
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний - до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие:
CH3C (O) CH3 ↔ С2Н5СОН ↔ СН2=С (ОН) - СН3
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи - 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое - с мочой.
Сырьё для синтеза многих важных химических продуктов: уксусного ангидрида, кетена, диацетонового спирта, окиси мезитила,метилизобутилкетона, метилметакрилата, дифенилпропана, изофорона, бифенола А и др.;
(CH3) 2CO + 2 C6H5OH → (CH3) 2C (C6H4OH) 2 + H2O
2. Вода - оксид водорода - одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, - она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода - хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды - диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н20 содержатся ассоциированные молекулы, т.е. соединенные в более сложные агрегаты (Н2О) x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н20-Н2S - Н2Sе) аномально высокая теплоемкость [4,18 кДж/ (г К)]. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода - весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р205, СаО, ВаО, металлический Ма (они тоже химически взаимодействуют с водой), а также силикагель.
К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения [].
Таблица 1. Равновесный состав смеси ацетон-вода
| x | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | Азеотропная смесь |
| t | 0 | 60,3 | 72 | 80,3 | 82,7 | 84,2 | 85,5 | 86,9 | 88,2 | 90,4 | 94,3 | 100 | - |
| y | 100 | 77,9 | 69,6 | 64,5 | 62,6 | 61,6 | 60,7 | 59,8 | 59 | 58,2 | 57,5 | 56,9 | - |
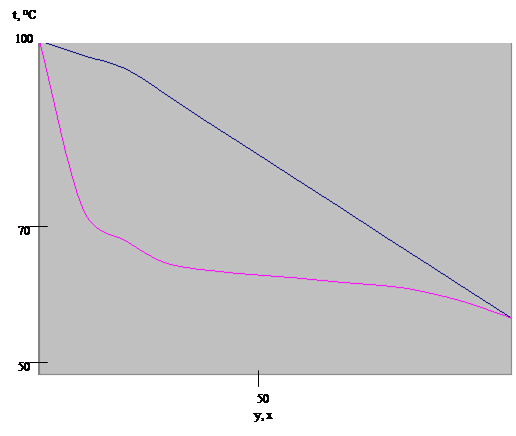 |
Рис.1. Диаграмма t-x,y для смеси ацетон - вода.
 2020-01-14
2020-01-14 379
379








