Для экстрагирования холестерина из плазматической мембраны нейтрофилов были использованы циклодекстрины двух видов – МbCD и bCD. Для анализа действия циклодекстринов на нейтрофилы и подбора оптимальных условий эксперимента по экстракции холестерина были протестированы различные концентрации данных веществ при варьировании их времен инкубирования с клетками.
Выделенные нейтрофилы инкубировали при 37°С в отсутствие (контроль) или в присутствие 10 мМ раствора МβCD или 15 мМ βCD в течение 5, 10, 20 или 30 мин. Затем каждую пробу центрифугировали 10 мин при 3000 об/мин. Содержание холестерина в полученных супернатантах нейтрофилов определяли спектрофотометрически с использованием соответствующего набора фирмы Анализ-Х (Минск, Беларусь) по интенсивности окраски исследуемой пробы. Интенсивность окраски пропорциональна содержанию холестерина в ней.
Содержание холестерина в исследуемой пробе рассчитывали как процент от общего содержания холестерина в клетках, лизированных под действием 0,1% Тритона Х-100 (рисунок 2.1).

Рисунок 2.1 – Выход холестерина из нейтрофилов, обработанных 15 мМ bCD и 10мМ MbCD
При этом условия обработки циклодекстринами были подобраны таким образом, чтобы жизнеспособность клеток не нарушалась.
Активность лактатдегидрогеназы (ЛДГ) в супернатантах определяли для оценки жизнеспособности нейтрофилов после инкубирования в присутствии МβCD или βCD с использованием набора реагентов фирмы “Анализ Х” (Минск, Беларусь).
Кинетический метод определения каталитической активности ЛДГ основан на ферментативной реакции:
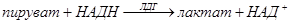
Восстановленная форма никотинамидадениндинуклеотида HAДH имеет выраженный максимум поглощения в ультрафиолетовой области на 340 нм, тогда как окисленная форма HAД+ этого максимума не имеет. Различия в поглощении НАД+ и НАДН между 300 и 400 нм обусловлены изменениями никотинамидного кольца при окислении или восстановлении.
Такие различия в спектрах поглощения позволяют следить за ходом ферментативной реакции, например, по уменьшению величины оптической плотности А на длине волны 340 нм, т.е. по уменьшению содержания HAДH в анализируемом образце.
В таблице 2.1 представлена активность ЛДГ в супернатанте необработанных клеток (контроль) и клеток, обработанных в bCD 15 мМ в течение 15 и 30 мин, относительно активности ЛДГ в супернатанте клеток, обработанных 0,1% Тритоном Х-100.
Таблица 2.1 – Выход ЛДГ из нейтрофилов после воздействия bCD 15мМ
| Активность ЛДГ (% от общей активности фермента) | ||
| Время обработки bCD | 15 мин | 30 мин |
| Контроль | 12,9 ± 7,9 | |
| bCD 15мМ | 12,4 ± 1,8 | 10,4 ± 0,9 |
Таким образом, можно видеть, что воздействие на клетки bCD в течение 15 и 30 мин не оказывает значительного влияния на жизнеспособность клеток.
2.4 Измерение генерации H2O2 нейтрофилами
Продукцию Н2О2 нейтрофилами оценивали флуоресцентным методом на компьютеризированном спектрофлуориметре LSF1211А (“СОЛАР”, Минск, Беларусь) с использованием скополетина в качестве субстрата пероксидазной реакции [3]. Лектины добавляли к 1,5 мл суспензии нейтрофилов (106 кл/мл в фосфатно-солевом буфере, 37°С), содержащей 1 мкМ скополетина, 20 мкг/мл пероксидазы хрена и 1 мМ NaN3. Кинетику окисления скополетина регистрировали по уменьшению интенсивности флуоресценции при 460 нм (возбуждение при 350 нм). Для характеристики процесса лектин-индуцированной генерации Н2О2 нейтрофилами использовали два параметра: скорость продукции Н2О2 и длительность лаг-периода этого процесса, которая зависит от скорости сборки функционально активного НАДФН-оксидазного комплекса в плазматической мембране. Скорость продукции Н2О2 клетками определяли как тангенс угла наклона линейного участка кинетической кривой, на котором происходит падение интенсивности флуоресценции скополетина в результате его окисления Н2О2 . Лаг-период генерации H2O2 принимали равным промежутку времени между моментом добавления лектина к суспензии клеток и началом уменьшения интенсивности флуоресценции на кинетической кривой (началом линейного участка).
 2020-01-14
2020-01-14 209
209








