Применение потенциометрического и кулонометрического методов анализа в фармации и аналитической химии.
Потенциометрический метод – это метод качественного и количественного анализа, основанный на измерении потенциалов, возникающих между испытуемым раствором и погруженным в него электродом. Данный метод рекомендуется для установления доброкачественности и количественного анализа некоторых фармакопейных препаратов. Использую потенциометрическое титрование, можно более объективно устанавливать точку эквивалентности, поэтому метод находит широкое практическое применение. Одним из направления потенциометрического метода является хронопотенциометрия. Сущность этого метода заключается в том, что потенциал одного их электродов записывают как функцию времени. Помимо аналитических целей метод может быть использован для изучения кинетики химических процессов. Потенциометрический метод также может быть использован при исследовании процессов разрушения лекарственных веществ при хранении.
Кулонометрический метод весьма перспективен для анализа лекарственных веществ: некоторых местноанестезирующих средств, сульфаниламидов, алкалоидов. Кулонометрический метод основан на законе Фарадея, устанавливающем связь между количеством вещества, выделившегося на электродах, и затраченным на этот процесс количеством электричества.
3. Построить кривые потенциометрического титрования в координатах E-V и ∆E/∆V-V и рассчитать концентрацию хлорида кальция в растворе (г/л), если при титровании 20,0 мл анализируемого раствора 0,0500 н. раствором Hg2(NO3)2 получили следующие данные:
| V Hg2(NO3)2, мл | 10,0 | 15,0 | 17,0 | 17,5 | 17,9 | 18,0 | 18,1 | 18,5 | 19,0 |
| Е, мВ | 382 | 411 | 442 | 457 | 498 | 613 | 679 | 700 | 709 |
По данным таблицы получим следующую кривую потенциометрического титрования в координатах E-V:
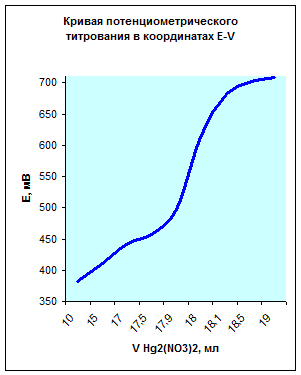
| V Hg2(NO3)2, мл | 10,0 | 15,0 | 17,0 | 17,5 | 17,9 | 18,0 | 18,1 | 18,5 | 19,0 |
| ∆E/∆V | 5,8 | 15,5 | 30 | 102,5 | 1150 | 660 | 52,5 | 18 |
Исходя из данных этой таблицы получим следующий график:
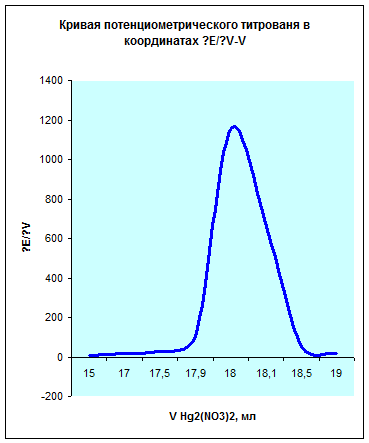
Из данных графиков видно, что точка эквивалентности соответствует 18мл Hg2(NO3)2. Отсюда можно рассчитать концентрацию хлорид кальция в растворе.
Уравнение реакции имеет следующий вид:
CaCl2+ Hg2(NO3)2® Hg2Cl2+Ca(NO3)2
m(Hg2(NO3)2)=Cн(Hg2(NO3)2)*Mэ(Hg2(NO3)2)*V(Hg2(NO3)2)
Нормальность данного раствора дана в условии задачи, объем определили по графику, осталось рассчитать Mэ.
Молярная масса эквивалента соли равна отношению мольной массы соли к произведению числа атомов металла на его валентность. Т.е., получим:
Mэ(Hg2(NO3)2)= 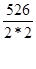 =131,5г/моль. Следовательно,
=131,5г/моль. Следовательно,
m(Hg2(NO3)2)=0,05*131,5*18*10-3=0,12г
CaCl2 и Hg2(NO3)2 реагируют в эквивалентном количестве, т.е. в реакцию вступает одинаковое количество молей этих веществ.
n(Hg2(NO3)2)= m(Hg2(NO3)2)/ M(Hg2(NO3)2)=0,12/586=0,2*10-3 моль. Значит, n(CaCl2) также равно 0,2*10-3 моль.
m (CaCl2)=n(CaCl2)*M(CaCl2);
m (CaCl2)= 0,2*10-3*111=0,022 г – это масса в 200 мл, следовательно масса в литре раствора составит: 0,022*5=0,11г
Т.е. концентрация хлорида кальция в растворе составит 0,11 г/л.
Ответ: с(CaCl2)= 0,11 г/л.
4. При фотометрировании раствора сульфосалицилатного комплекса железа получили относительную оптическую плотность раствора 0,55. Раствор сравнения содержал 0,0288 мг железа в 25 мл. Толщина поглощающего слоя 2 см. Определить концентрацию и массу железа в 100 мл анализируемого раствора, если ε комплекса в этих условиях равен 3000 л/(моль·см).
D=eDcl, где e - коэффициент пропорциональности, который не зависит от концентрации, а зависит только от природы растворенного вещества;
Dc=с1-с0 – разность между концентрциями исследуемого раствора и эталонного;
l – толщина поглощающего слоя.
Отсюда, с1=D/(e*l)+ с0
Для начала необходимо вычислить с0.
 2020-04-20
2020-04-20 635
635







