Федеральное агентство по образованию
ГОУ ВПО Сибирский государственный технологический университет
Факультет: Химических технологий
Кафедра: Органической химии и технологии органических веществ
Синтез и свойства новых биологически активных соединений на
основе β-дикетонов нафталинового ряда
(ОХ и ТОВ. 000000.148.ПЗ)
Дипломник И.А. Кашара
Зав. кафедрой Г.А. Субоч
Руководитель М.С. Товбис
Консультанты
Технологической части
Конструкторской части
Научно
Исследовательской части А.В. Любяшкин
Безопасности
И экологичности проекта В.Г. Горчакова
Экономической части С.И. Кузичкин
Нормоконтроль Н.А. Гаврилова
Реферат
Дипломная работа выполнена по теме «Синтез и свойства новых биологически активных соединений на основе β-дикетонов нафталинового ряда».
Пояснительная записка состоит из введения, литературного обзора, в котором рассмотрены методы синтеза ароматических соединений, обсуждения результатов, экспериментальной части, выводов, безопасности и экологичности работы и технико-экономических показателей.
В работе описаны эксперименты по введению α- и β-нафтильных заместителей в нитрозоароматические системы. По разработанным методикам впервые получены нитрозопиразолы, содержащие α- и β нафтильные заместители.
Пояснительная записка содержит 57 с. текста, 15 таблиц, 5 рисунков, 19 схем, 59 литературных источников. Графическая часть состоит из 5 листов формата А1.
Введение
Сложность создания новых высокоэффективных лекарственных препаратов обусловлена многообразием факторов, влияющих на фармакологический эффект. Из многих тысяч полученных из природного сырья или синтезированных веществ только единицы оказываются эффективными.
Создание оригинальных лекарственных препаратов очень долгий и трудоемкий процесс. Есть два пути создания новых лекарственных препаратов. Один, имеющий более чем вековую историю, - эмпирический. Другой путь - направленный поиск. Эффективность поиска биологически активных соединений составляет в настоящее время около 0,02%, а по другим данным даже 0,01%, т.е. в среднем из 5000-10000 синтезированных и проверенных на активность соединений, в практику внедряются только одно лекарственное вещество.
Эмпирический поиск осуществляется классическим методом проб и ошибок. Исходя из эмпирически установленных закономерностей о влиянии тех или иных функциональных групп на биологическую активность, осуществляют синтез ряда соединений. Затем проводят предварительные испытания, отбирают наиболее активные вещества, которые подвергаются всестороннему фармакологическому исследованию [1].
Направленный поиск заключается в теоретическом предсказании биологической активности вещества по его химической структуре и осуществлении направленного синтеза этой структуры.
Перспективным направлением в создании оригинальных лекарственных препаратов может служить поиск новых химико фармацевтических препаратов гетероароматического ряда [1].
Известен ряд гетероароматических соединений, проявляющих антибактериальную активность. К ним относятся производные хиноксолина[1], нитрофурана, 8-и 4- гидроксихинолинов, нафтиридина, пиразолона [1]. Все эти соединения обладают достаточно широким спектром действия. Поэтому настоящая дипломная работа посвящена поиску новых, ранее неизвестных соединений пиразольного ряда.
Аналитический обзор
Большое значение для химии фармацевтических препаратов имеют гетероароматические соединения, проявляющие антибактериальную активность, например, производные пиразолона [1].
Первым в этом ряду стоит пиразол, который имеет ароматический характер и способен вступать в реакции замещения. Водород у атома азота имеет слабовыраженный кислотный характер. Двойные связи в гетероцикле могут частично или полностью гидрироваться, давая при этом пиразолин и пиразолидин.
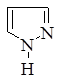
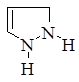
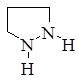
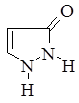
пиразол пиразолин пиразолидин 5-пиразолон
Наиболее распространёнными лекарственными веществами в ряду этих соединений являются производные 5-пиразолона, проявляющие жаропонижающее и болеутоляющее действия.
Общую структурную формулу препаратов данной группы можно представить следующим образом:
R Название
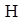 Антипирин
Антипирин
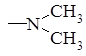 Амидопирин
Амидопирин
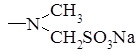 Анальгин
Анальгин
Исходным продуктом для получения этой группы препаратов служит 3-метил-1-фенил-5-пиразолон, который является продуктом крупнотоннажного производства анилинокрасочной промышленности (его получают конденсацией фенилгидразина с дикетонами или ацетоуксусным эфиром).
. Антипирин (Antipyrinum). 1-Фенил-2,3-диметилпиразолон-5:
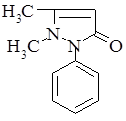
Бесцветные кристаллы или белый кристаллический порошок без запаха, слабо горьковатого вкуса.
Антипирин является одним из производных пиразолона. Препараты этой группы оказывают болеутоляющее, жаропонижающее и в той или другой степени противовоспалительное действие. По анальгезирующей и жаропонижающей активности они близки к производным салициловой кислоты. Производные пиразолона уменьшают проницаемость капилляров и препятствуют развитию воспалительных реакций.
Антипирин оказывает умеренное анальгезирующее, жаропонижающее и противовоспалительное действие. При местном применении оказывает некоторое кровоостанавливающее действие. Применяют антипирин внутрь при невралгиях, хорее, простудных заболеваниях.
Антипирин является промежуточным продуктом в синтезе амидопирина и анальгина.Его получают следующей схеме.
Схема 1
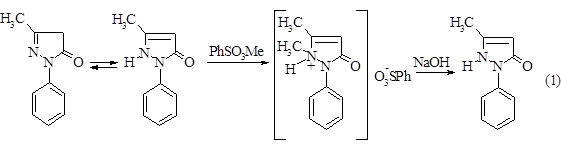
Далее антипирин экстрагируют из реакционной массы дихлорэтаном, перекристализовывают из смеси изопрапанол - этанол и направляют на дальнейшую отчистку или далее на стадию получения амидопирина (пирамидона) и анальгина.
. Амидопирин (Amidopyrinum). 1-Фенил-2,3-диметил-4 диметиламинопиразолон-5:
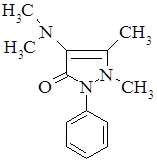
Белые кристаллы, или белый кристаллический порошок, без запаха, слабогорького вкуса. Медленно растворим в воде, легко растворим в спирте.
Оказывает жаропонижающее, болеутоляющее и профилактическое действие. По фармакологическим свойствам амидопирин близок к антипирину, но активнее его.
Применяют амидопирин при головной боли, неврозах, артритах, миозитах, хорее, а также при остром суставном ревматизме.
При длительном лечении амидопирином необходимо периодическое исследование крови, так как в отдельных случаях может наблюдаться угнетение кроветворения (гранулоцитопения и агранулоцитоз). Иногда развиваются кожные сыпи.
Амидопирин выделяется с мочой. Продукты его распада (рубазоновая кислота) могут предавать моче темно-желтую или красную окраску.
Получают амидопирин из антипирина по следующей схеме.
Схема 2
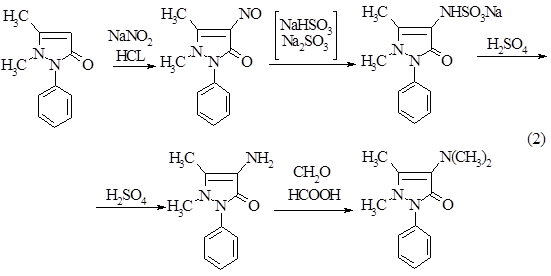
. Восстановление нитрозосоединения солями сернистой кислоты можно представить следующим образом
Схема 3:
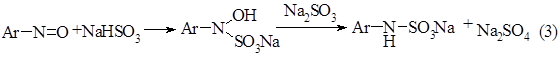
. Метилирование по аминогруппе проходит через образование диметилольного производного, которое в результате отщепления двух молекул воды образует алкилированный продукт.
Ссхема 4:
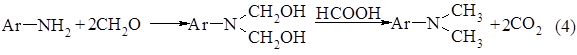
. Анальгин (Analginum). 1-Фенил-2,3-диметил-4 метиламинопиразолон-5-N-метансульфонат натрия:
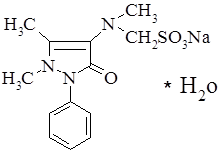
Белый, или белый с едва заметным желтоватым оттенком, кристаллический порошок. В присутствии влаги быстро разлагается. Легко растворим в воде, трудно в спирте.
Анальгин обладает весьма выраженными анальгезирующим, противовоспалительным и жаропонижающим действием. По характеру действия близок к антипирину; как хорошо растворимый и легко всасывающийся препарат он особенно удобен для применения в тех случаях, когда необходимо быстро создать в крови высокую концентрацию препарата. Хорошая растворимость даёт возможность широко пользоваться анальгином для парэнтерального введения.
Часто анальгин назначают вместе с амидопирином, фенацетином, фенобарбиталом, кофеином и другими средствами.
Одновременное назначение анальгина и амидопирина позволяет получить быстрый (за счёт быстрого поступления в кровь анальгина) и длительный (за счёт более медленного всасывания и выделения амидопирина) лечебный эффект.
Применяют анальгин при болях различного происхождения (головная боль, невралгия, радикулиты, миозиты), лихорадочных состояниях, гриппе, ревматизме, хорее.Анальгии получают по следующей схеме.
Схема 5:
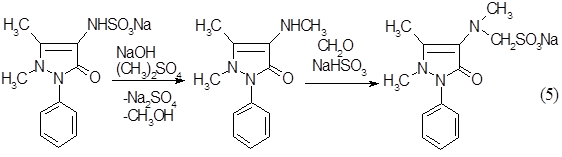
Следует отметить, что антипирин и амидопирин в настоящее время заменены другими, более эффективными средствами. Анальгин сохраняет свое значение как болеутоляющее средство. Хорошая растворимость в воде и устойчивость при стерилизации позволяют использовать его для парентерального введения.
В настоящее время продолжается интенсивный поиск новых производных пиразола, которые могут проявлять биологическую активность. Так, в последние годы были синтезированы соединения, которые имели в своей структуре ароматические конденсированные системы, например нафтильные заместители в пиразольном кольце.
Соединение такого типа синтезировали индийские ученые в 1990г [3].
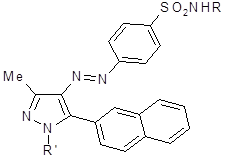
R= H; Ph; 4-CH3C6H4; замещенный пиридинил.’= 4-CH3C6H4; 1,3-триметилбицикло[2,2,1]гептан-2-ил.
Синтез вели по реакции сочетания 1-метил-3-(2-нафтил)пропан-1,3-диона с пара-замещенными бензоилдиазоний хлоридами с последующей циклизацией образующегося 2-арилазо-1-метил-3-(2-нафтил)пропана-1,3-диона с замещенными гидразинами. Некоторые из продуктов обладают антибактериальными и фунгицидными свойствами.
В связи с этим представляет большой интерес получение соединений, содержащих в 5-м положении пиразольного кольца нитрозогруппу.
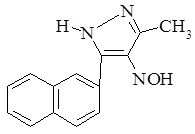
Соединение такого строения может быть использовано для введения иных функциональных групп в гетероциклическое кольцо, т.к. нитрозогруппу легко превратить в аминогруппу, ацетаминогруппу, алкил- и диалкиламиногруппу и другие.
Простым нитрозированием невозможно получить соединение такого строения. Однако на кафедре органической химии СибГТУ в последние годы ведутся исследования по получению нитрозофенолов с различными заместителями в ароматическом кольце циклоароматизацией изонитрозо-b-дикетонов с кетонами.
Так, методом циклоароматизации из алкилизонитрозо-b-дикетонов и алкилкетонов удается получить алкил-орто-нитрозофенолы.
Схема 6
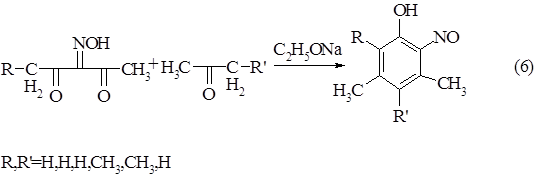
Если в реакцию вводят изонитрозо-b-дикарбонильное соединение с арильным или гетерильным заместителем, то в качестве продукта образуются исключительно пара- изомеры нитрозофенолов с этими же заместителями в кольце [5]. Такие соединения можно рассматривать как производные дифенила или фенилгетерила.
Схема 7
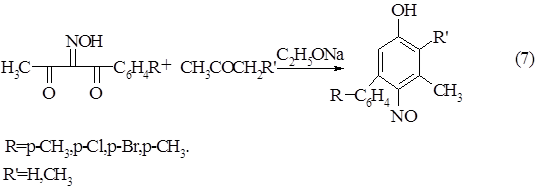
Метод циклоароматизации позволяет также получать диарилзамещенные нитрозофенолы [6-9]. Конденсацию при этом проводят в трет-бутилате калия, чтобы избежать распада изонитрозодибензоилметана в этилате натрия.
Схема 8
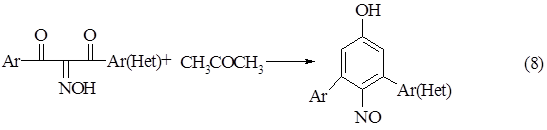
При конденсации изонитрозодикетонов с диэтиловым эфиром ацетондикарбоновой кислоты в молекулу нитрозофенолов вводятся сложноэфирные заместители.
Схема 9
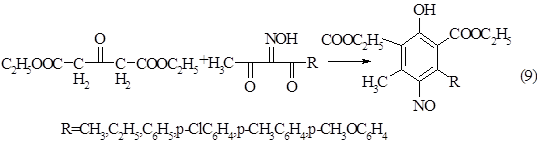
Однако, несмотря на столь широкие возможности использования этой реакции синтеза нитрозофенолов, изучены далеко не все аспекты ее применения. Так, не было сделано попыток ввести в ядро в качестве заместителя ароматические конденсированные системы - нафталин, фенантрен, антрацен. Подобные реакции могут привести к получению принципиально иных соединений. Если продукты известной реакции циклоароматизации представляли собой нитрозопроизводные бензола, дифенила и трифенила, то успех в использовании b-дикетонов нафталинового ряда в подобном синтезе даст возможность получения уникальных производных фенилнафтилов, а в реакции с гидразином - производных нафтилзамещенных пиразолов и других ранее недоступных веществ.
Для осуществления этих реакций необходимы соответствующие изонитрозосоединения нафталинового ряда. В литературе такие соединения не описаны, однако известен метод синтеза b-дикетонов ряда нафталина путем конденсации соответствующих ацетонафтонов с этилацетатом [10].
Методы синтеза исходных a- и b-ацетонафтонов также описаны в литературе. Так, a-ацетонафтон можно получить действием хлористого ацетила на нафталин в присутствии безводного хлорида алюминия в среде дихлорэтана [11]. Иногда его получают из ацетонитрила и магнийорганических реагентов [12-17]. b-Ацетонафтон можно синтезировать действием хлористого ацетила на нафталин в присутствии безводного хлорида алюминия в среде нитробензола [18,19].
Исходя из вышеизложенного, целью настоящей работы стал поиск методов синтеза изонитрозопроизводных b-дикетонов нафталинового ряда и получение на их основе недоступных ранее гетероциклических нитрозосоединений.
Задачами, поставленными в настоящем исследовании, стали:
· Отработка методов синтеза и получение a- и b-ацетонафтонов.
· Отработка методов синтеза и получение a- и b-нафтоилацетонов.
· Изучение реакции нитрозирования нафтоилацетонов, синтез и установление строения неизвестных ранее изонитрозо-a- и b- нафтоилацетонов.
· Исследование реакции циклизации изонитрозо-a- и b- нафтоилацетонов с гидразином, позволяющей получать a-, b- нафтилзамещеные нитрозофенолы
Обсуждение результатов
Для реализации поставленной в нашем исследовании цели мы наметили проведение синтезов по следующей схеме
Схема 15
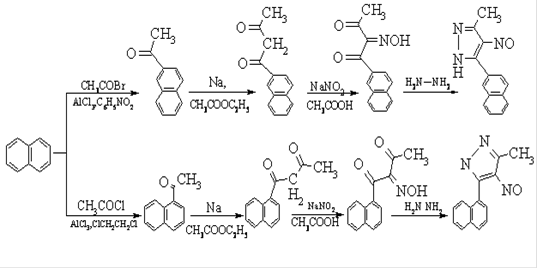
На первой стадии мы провели ацилирование нафталина по реакции Фриделя-Крафтса, причем когда реакцию проводили в среде дихлорэтана, то получали α-ацетонафтон, а в среде нитробензола - β-ацетонафтон (см. экспериментальная часть, стр.13,15)
Следующим шагом нашей работы стало получение α- и β-нафтоилацетонов. Эту реакцию осуществляли в условиях, аналогичных проведению реакции конденсации Кляйзена. Для этого этилацетат вводили в реакцию с α- и β-ацетонафтонами в среде абсолютного эфира (см. экспериментальная часть, стр.14,17). В результате с выходом 44,5% получили α-ацетонафтон и с выходом 68,5% β-ацетонафтон.
Следующим шагом в реализации приведенной схемы стало нитрозирование полученных α- и β- нафтоилацетонов. Это нитрозирование проведено нами впервые.
Нитрозирование b- нафтоилацетона
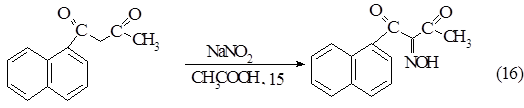
Загрузка: b-нафтоилацетон - 4,3 г (0,202 моль)
Нитрит натрия - 1,55 г (0,022 моль)
Уксусная кислота - 20,2 мл.
Растворяли 4,2 г (0,202 моль) b-нафтоилацетона в 20,2 мл ледяной уксусной кислоте при 80°С, охлаждали до 15°С и стали добавлять 1,55 г (0,022 моль) сухого нитрита натрия так, чтобы температура не поднималась выше 15°С (магнитная мешалка, водяная баня). После того, как добавили весь нитрит натрия, баню убирали и оставляли на 2 часа. Смесь загустевала и приобретала светло-коричневый цвет. Разбавляли полученную смесь 200 мл ледяной воды. Полученное соединение выпадало в осадок, его отфильтровывали. Температура плавления сырого изонитрозо-b-нафтоилацетона составляла 135-136 °С.
Перекристаллизацию проводили из кипящей воды (объем воды составил 750 мл). Горячий раствор фильтровали через подогретый пористый стеклянный фильтр и охлаждали раствор сначала до комнатной температуры, потом в холодильнике. Выпадали бесцветные иглы. Их опять фильтровали, затем сушили в эксикаторе под вакуумом. Получили 2,8 г продукта. Выход составил 57%. Температура плавления в капилляре 157-158°С. В ЯМР 1Н спектре в гексадейтеродиметилсульфоксиде присутствует сигнал метильной группы в виде синглета с хим. сдвигом 2,54 м.д. и сигналы всех протонов нафталинового кольца в области 7,6-8,4 м.д. Анализ на CHN: вычислено - C-69.7% H-4.6% N-5.81%, найдено - C-69.9% H-4.6% N-5.80%.

1 2 3
Рис 1.1. Тонкослойная хроматограмма изонитрозо-b-нафтоилацетона на пластинках Silufol UV-254 (Элюент: этилацетат- толуол 1:2). 1-ТСХ реакционной смеси; 2- ТСХ сырого продукта; 3- ТСХ перекристаллизованного изонитрозо-b-нафтоилацетона.
Нитрозирование α- нафтоилацетона
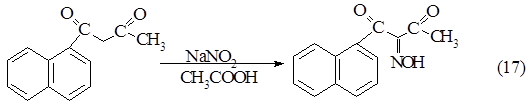
Провели по методике, аналогичной получению b-нафтоилацетона.
Загрузка: α -нафтоилацетон - 5,1 г (0,023 моль)
Нитрит натрия - 1,785 г (0,00162моль)
Уксусная кислота - 238 мл.
Получили 4 г сырого маслянистого продукта. После перекристаллизации из горячей воды выход составил 69%.Температура плавления в капилляре 170°С.
Результаты СНN анализа: Найдено: C- 63,68 %, H-4,86 %, N-5,45 %.
Вычислено: C-63,37 %, H-4,56 %, N-5,81 %.

1 2 3
Рис 1.2 Тонкослойная хроматограмма изонитрозо-a-нафтоилацетона на пластинках Silufol UV-254 (Элюент: этилацетат- толуол 1:2). 1-ТСХ реакционной смеси; 2- ТСХ сырого продукта; 3- ТСХ перекристаллизованного изонитрозо-a-нафтоилацетона
Известно, что изонитрозо-b-дикарбонильные соединения вступают в реакцию с гидразином, образуя производные нитрозопиразола [20].
Поэтому на последнем этапе мы провели конденсацию полученых изонитрозо-α- и β-нафтоилацетонов с гидразином.
Конденсация изонитрозо-b-нафтоилацетона с гидразином
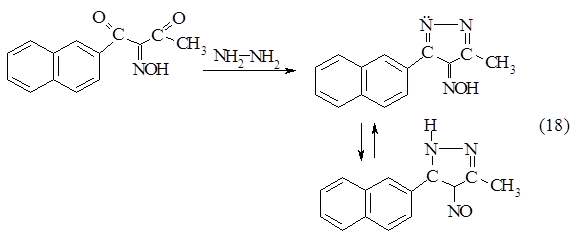
Загрузка: Na2СO3 -0,34 г (0,0032 моль)
Н2О - 2,28 мл;2 - NH2 • Н2 SO4 - 0,37 г (0,0029 моль);
Изонитрозо b-нафтоилацетон - 0,7 г (0,0029 моль).
,34 г (0,0032 моль) соды растворяли в 2,28 мл воды при постоянном перемешивании на магнитной мешалке, добавляли 0,37 г (0,0029 моль) сульфат гидразина. В течение 15 минут добавляли 0,7 г (0,0029 моль) изонитрозо-b-нафтоилацетона при комнатной температуре.
Об окончании реакции судили по хроматограмме (рис. 1.3.). Бесцветное пятно, соответствующее изонитрозо-b-дикетону, видимое при ультрафиолетовом освещении или при проявлении парами йода, по мере протекания реакции исчезало, при этом появлялось ярко-зелёное пятно конечного продукта. Через 2 ч 40 мин. цвет смеси изменился с бледно-бежевого на салатово-зеленый. Получили 0.7 г продукта - предполагаемого 3-метил-5-b-нафтил-4-пиразолон-4-оксима.Температура плавления 1530С. Продукт перекристаллизовали из спирта. В ЯМР 1Н спектре в гексадейтеродиметилсульфоксиде присутствует сигнал метильной группы пиразольного кольца виде синглета с хим. сдвигом 2,29 м.д. и сигналы всех протонов нафталинового кольца в области 7,5-8,8 м.д. Анализ на CHN: вычислено - C-70.87% H-4.67% N-17.81%, найдено - C-70.12% H-4.62% N-16.86%. Данные УФ и ИК спектров также подтвердили строение нового изонитрозодикетона и нитрозопиразола.
1 2 3 4
Рис 1.3. Тонкослойная хроматограмма 3-метил-5-β-нафтил-4-пиразолон-4-оксима на пластинках Silufol UV-254 (Элюент: этилацетат- толуол 1:2). 1-ТСХ реакционной смеси; 2- ТСХ реакционной смеси через 1 час; 3- ТСХ сырого продукта; 4- ТСХ перекристаллизованного из спирта продукта.
В УФ-спектре 3-метил-5-β-нафтил-4-пиразолон-4-оксима в области 720 нм присутствует максимум поглощения, соответствующий n ® p* переходу нитрозогруппы. Наличие такого поглощения говорит о том, что продукт находится в форме нитрозотаутомера и представляет собой 3-метил-4-нитрозо-5-β-нафтилпиразол.
Конденсация изонитрозо-α-нафтоилацетона с гидразином
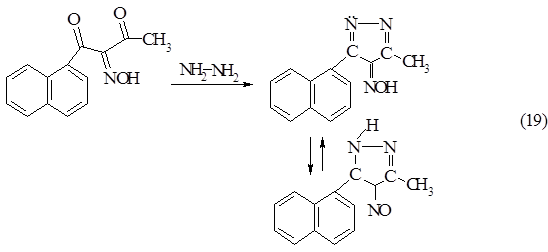
Загрузка: Na2СO3 - 0,24 г (0,003 моль)
Н2О - 2,2 мл2 - NH2 • Н2 SO4 - 0,26 г (0,0026 моль)
Изонитрозо-α-нафтоилацетон - 0,5 г (0,0025 моль) 0,24 г (0,003 моль) соды растворяли в 2,2 мл воде при постоянном перемешивании на магнитной мешалке, добавляли 0,26 г (0,0027 моль) сульфат гидразина. В течение 15 минут добавляли 0,5 г (0,0025 моль) изонитрозо-b-нафтоилацетон при температуре 70°С.
Об окончании реакции судили по тонкослойной хроматограмме (рис.1.4). Бесцветное пятно, соответствующее изонитрозо-a-дикетону, видимое при ультрафиолетовом освещении или при проявлении парами йода, по мере протекания реакции исчезало, при этом появлялось ярко-зелёное пятно конечного продукта. Через 30 мин. цвет смеси полностью изменился с бледно-бежевого на зеленый. Для выделения чистого продукта, смесь проэкстрагировали эфиром и в эфирный экстракт добавили активированный уголь. Смесь отфильтровали и дали эфиру испариться. Осадок затерли в петролейном эфире. Получили 0,31 г продукта (62,5% от теоретического) - предполагаемого 3-метил-5-α-нафтил-4-пиразолон-4-оксима. Температура плавления 980С.
Результаты СНN анализа: Найдено: C- 62,15 %, H- 4,82 %, N- 14,12 %.
Вычислено: C- 70,88 %, H- 4,64 %, N- 17,72 %.
2 3 4
Рис 1.4. Тонкослойная хроматограмма 3-метил-5-α-нафтил-4-пиразолон-4-оксима на пластинках Silufol UV-254 (Элюент: этилацетат- толуол 1:2). 1-ТСХ реакционной смеси; 2- ТСХ реакционной смеси через 1 час; 3- ТСХ сырого продукта; 4- ТСХ перекристаллизованного из спирта продукта
В УФ-спектре 3-метил-5-a-нафтил-4-пиразолон-4-оксима в области 720 нм присутствует максимум поглощения, соответствующий n ® p* переходу нитрозогруппы. Наличие этого максимума поглощения подтверждает, что продукт находится в форме нитрозотаутомера и представляет собой 3-метил-4-нитрозо-5-a-нафтилпиразол.
Таким образом, в результате проделанной работы нам удалось расширить представления о границах применения реакции циклоароматизации. Впервые с помощью данной реакции введены a- и β-нафтильные заместители в нитрозоароматическую систему.
 2020-04-20
2020-04-20 250
250







