CH3COOC2H5 + NaOH ® CH3COONa + C2H5OH;
n = kCCH 3 COOC 2 H 5 × CNaOH
CH3Br+KOH ®CH3OH+KBr;
n= kCCH Br × CKOH 3
Реакции третьего порядка.
2NO + O2 ® 2NO2;
n = kCNO 2 × CO 2
Для элементарных реакций вместо порядка реакции говорят о её молекулярности.
Молекулярность реакции равна числу частиц (молекул, радикалов, атомов), принимающих участие в элементарной реакции или элементарном акте реакции.
Коэффициенты a и b в этих уравнении носят название "молекулярность" реакции по веществу А и В, соответственно; сумма (a + b) - суммарная (общая) молекулярность простой реакции. Понятие "молекулярность" применимо только к простой реакции. Вычисления и наблюдения показывают, что (a + b) не может быть больше трех. Если для какой-либо реакции эта сумма больше трех, то можно утверждать, что реакция сложная. По количеству сталкивающихся в элементарном акте молекул реакции называют моно-, би- и тримолекулярными.
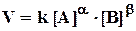
Коэффициенты aи b в уравнении для сложных реакций носят название "частный порядок" реакции по веществу А и В, соответственно, а сумма:
(a + b)=n общий порядок реакции.
Эти коэффициенты находят экспериментально, и они могут быть целыми, дробными, отрицательными и равными нулю.
Порядок и молекулярность простой реакции обычно совпадают, но если, например, концентрация одного из реагентов много больше, чем других, то скорость практически не зависит от этой концентрации и, хотя в реакции участвуют все молекулы, ее порядок будет меньше молекулярности. На этом основано нахождение порядков реакций по веществам - метод понижения порядка реакции.
Молекулярность реакции всегда целочисленна, положительна и не превышает трех. Примером монолекулярных реакций могут служить реакции изомеризации (внутримолекулярной перегруппировки), термического разложения:
СНзNСНз → С2Н6 + N2 (разложение азометана);
CH3OCH3 → CH4 + H2 + CO (разложение диметилового эфира).
Примеры бимолекулярных реакций:
H2 + J2 → 2HJ;
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Тримолекулярных реакций известно не много. Это, например, реакции
2NO + H2 → N2O + H2O;
2NO + O2 → 2NO2.
Молекулярность - это теоретическое понятие. Она отражает механизм реакции, дает представление о том какие именно и через какие стадии идет образование продуктов.
В простых (элементарных) реакциях, протекающих в одну стадию порядок реакции и молекулярность совпадают и имеют целое положительное значение. Для большинства реакций порядок реакции меньше молекулярности. Порядок реакции зависит от условий (концентрации, давления) протекания процесса. Рассмотрим случаи несовпадения порядка реакции и молекулярности:
1) Большой избыток одного из реагирующих веществ.
HCOOC2H5 + H2O → HCOOH + C2H5OH;
n = kCHCOOC 2 H 5 × CH 2 O
Порядок = 1; молекулярность = 2.
2) Для гетерогенных реакций
CaO(тв) + CO2(г) → CaCO3(тв)
учитывается концентрация только газообразных веществ:
n = kCСO 2
Порядок = 1; молекулярность = 2.
ФОРМАЛЬНАЯ КИНЕТИКА
Раздел химической кинетики, который математически описывает зависимость скорости реакций от концентрации реагентов, называется формальной кинетикой. Аппарат формальной кинетики позволяет рассчитать количество всех участников реакции в любой момент времени. Рассмотрим кинетические уравнения односторонних реакций, порядок которых дается целым числом.
 2020-04-12
2020-04-12 125
125








