Теория сплавов. Кристаллизация, строение и свойства сплавов. Диаграмма состояния.
Понятие о сплавах и методах их получения
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Возможны другие способы приготовления сплавов: спекания, электролиз, возгонка. В этом случае вещество называется псевдосплавом.
Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называется металлическим сплавом. Сплавы обладают более разнообразным комплексом свойств по сравнению с чистыми элементами.
Основные понятия в теории сплавов.
Система – группа тел выделяемых для наблюдения и изучения.
В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов.
Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения.
Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются.
Кристаллизация, строение и свойства сплавов.
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов.
В зависимости от характера взаимодействия компонентов различают сплавы:
1. механические смеси;
2. твердые растворы.
3. химические соединения;
Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием металлического химического соединения.
Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов (рис. 4.1). В сплавах механических смесях сохраняются кристаллические решетки компонентов. По границам кристаллы разных типов плохо связаны между собой, и обычно сплавы механические смеси имеют низкую пластичность и ударную вязкость. Примером механических смесей являются сплавы свинец – сурьма (Pb – Sb), алюминий – кремний (Al – Si).
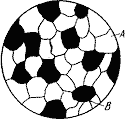
Рис. 4.1. Схема микроструктуры механической смеси
Сплавы твердые растворы –это сплавы, в которых один из металлов (растворитель, он содержится в наибольшем количестве) сохраняет свою собственную кристаллическую решетку, а другие металлы и неметаллы в этой кристаллической решетке располагаются в виде атомов ВНЕДРЕНИЯ или атомов ЗАМЕЩЕНИЯ (рис. 4.2). При образовании твердых растворов происходит искажение кристаллической решетки металла – растворителя. Наиболее заметное искажение происходит в твердых растворах внедрения. В растворах замещения искажение решетки менее заметно и зависит от размеров атомов замещения – чем они больше, тем решетка искажена сильнее. Чем больше общее искажение решетки, тем сильнее затруднено движение дислокаций, значит выше прочность и твердость сплава, но ниже пластичность. Твердый раствор, как чистый компонент состоит из однородных зерен (рис. 4.2).
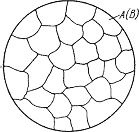
Рис.4.2. Схема микроструктуры твердого раствора
Классификация сплавов твердых растворов.
По степеням растворимости компонентов различают твердые растворы:
· с неограниченной растворимостью компонентов;
· с ограниченной растворимостью компонентов.
При неограниченной растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента.
Для образования растворов с неограниченной растворимостью необходимы:
1. изоморфность (однотипность) кристаллических решеток компонентов;
2. близость атомных радиусов компонентов, которые не должны отличаться более чем на 15%.
Неограниченно растворяются в твердом состоянии металлы с ГЦК решеткой, имеющие небольшую разницу в атомных размерах, как Au и Ag, Ni и Сu.
При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела. При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси.
По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы:
· замещения;
· внедрения;
· вычитания.
В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента (рис. 4.3 а). Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
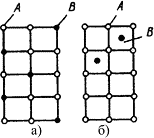
Рис.4.3.Схема кристаллической решетки твердых растворов замещения (а), внедрения (б)
При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются. Изменение параметров решетки при образовании твердых растворов – важный фактор, определяющий изменение свойств. Уменьшение параметра ведет к большему упрочнению, чем его увеличение.
Твердые растворы внедрения образуются внедрением атомов растворенного компонента в междоузелья (пустоты) кристаллической решетки растворителя (рис. 4.3 б).
Образование таких растворов, возможно, если атомы растворенного элемента имеют малые атомные радиусы. Такими являются элементы, находящиеся в начале периодической системы Менделеева, бор, углерод, водород, азот, кислород. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Концентрация таких атомов обычно не превышает 2%
Твердые растворы вычитания или растворы с дефектной решеткой. образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке.
Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, и если сила взаимодействия между разнородными атомами больше, чем между однородными. Химическое соединение обозначаются Аn Вm.
Особенности сплавов:
1. Постоянство состава, то есть сплав образуется при определенном соотношении компонентов;
2. Образуется новая кристаллическая решетка, резко отличающаяся от решеток элементов, составляющих химическое соединение; (рис. 4.4)
3. Ярко выраженные индивидуальные свойства;
4. Постоянство температуры кристаллизации, как у чистых компонентов;
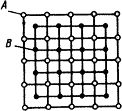
Рис. 4.4. Схема кристаллической решетки химического соединения
Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимальной внутренней энергией
Основным отличием является большая роль диффузионных процессов, между жидкостью и кристаллизующейся фазой. Эти процессы необходимы для перераспределения разнородных атомов, равномерно распределенных в жидкой фазе.
В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные полиморфными превращениями компонентов сплава, распадом твердых растворов, выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры.
Эти превращения называют фазовыми превращениями в твердом состоянии.
При перекристаллизации в твердом состоянии образуются центры кристаллизации и происходит их рост.
Обычно центры кристаллизации возникают по границам зерен старой фазы, где решетка имеет наиболее дефектное строение, и где имеются примеси, которые могут стать центрами новых кристаллов. У старой и новой фазы, в течение некоторого времени, имеются общие атомные плоскости. Такая связь решеток называется когерентной связью. В случае различия строения старой и новой фаз превращение протекает с образованием промежуточных фаз.
Нарушение когерентности и обособления кристаллов наступает, когда они приобретут определенные размеры.
Процессы кристаллизации сплавов изучаются по диаграммам состояния.
Диаграмма состояния.
Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5)
. 
Рис. 4.5. Диаграмма состояния
Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.
В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные площадки, вызванным тепловым эффектом превращений.
Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус.
По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.
Шкала концентраций показывает содержание компонента В.
Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4).
По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава.
Диаграммы состояния двухкомпонентных сплавов.
 2020-04-12
2020-04-12 110
110







