Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. В зависимости от типа химической реакции (гомогенная или гетерогенная) меняется характер реакционного пространства. Гомогенной реакцией называется реакция, протекающая в однородной среде (в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например, твердой и жидкой, твердой и газообразной.
Реакционным пространством гомогенных реакций является объем, заполненный реагентами. Так как отношение количества к единице объема называется концентрацией с, то скорость гомогенной реакции равна изменению концентрации исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна:
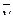 = (c2 – c1)/(t2 – t1) = ± Δc/Δt,
= (c2 – c1)/(t2 – t1) = ± Δc/Δt,
где c2 и c1 – концентрации исходного вещества в момент времени t2 и t1.
Знак минус означает, что концентрация исходного вещества уменьшается. В ходе реакции изменяются концентрации реагирующих веществ и соответственно скорость реакции. Скорость реакции в данный момент времени или, мгновенная (истинная скорость) реакции ν, равна:
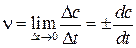 (в СИ моль ∙ л-1 ∙ с-1).
(в СИ моль ∙ л-1 ∙ с-1).
Скорость реакции всегда положительна, поэтому знак (-) берется, если c – концентрация исходного вещества,(c убывает) и со знаком (+), если c – концентрация продукта реакции (c возрастает).
Скорость химической реакции зависит:
1. От концентрации реагирующих веществ.
2. От температуры.
3. От ускоряющего или замедляющего действия катализатора.
4. От физических и химических свойств самих веществ, вступающих в реакцию.
Скорость некоторых гетерогенных реакций зависит также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция.
 2020-04-12
2020-04-12 96
96








