Необходимым условием того, чтобы между частицами (молекулами, ионами) исходных веществ произошло химическое взаимодействие, является их столкновение (соударение). Точнее говоря, частицы должны сблизиться друг с другом настолько, чтобы атомы одной из них испытывали бы действие электрических полей, создаваемых атомами другой. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ – продуктов реакции. Поэтому скорость веществ пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соударений тем больше, чем выше концентрация каждого из исходных веществ.
Зависимость скорости химической реакции от концентрации определяется законом действия масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, причем каждая концентрация входит в произведение в степени, равной коэффициенту, стоящему перед формулой данного вещества в уравнении реакции.
Например, для реакции
aA+bB=cC
Обозначив концентрации веществ A и B через [A] и [B], можно записать кинетическое уравнение:
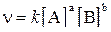 ,
,
где a и b – коэффициенты в уравнении реакции, k – коэффициент пропорциональности, называемый константой скорости данной реакции. Величина константы скорости k зависит от природы реагирующих веществ, от температуры, от присутствия катализаторов, но не зависит от концентрации веществ.
Аналогично для реакции:
2A+B=C или A+A+B=C можно записать как:

В качестве примера приложения закона действия масс можно привести уравнение зависимости скорости реакции окисления оксида азота (II):
2NO+ 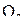 =2
=2 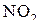
от концентрации NO и 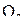 :
:
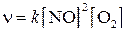
Гетерогенные реакции протекают на границе раздела фаз (например, твердой и жидкой, жидкой и газообразной), которая и служит реакционным пространством.
Если площадь поверхности равна S то общая скорость гетерогенной реакции описывается уравнением:
 ,
,
где с – концентрация реагента (газообразного или жидкого). Скорость гетерогенной химической реакции измеряется в [моль ∙ с-1].
Если в химической реакции непосредственно участвует твердое вещество, то в кинетическое уравнение не входит его концентрация, т.к. она постоянна. Роль твердого тела в кинетике отражается путем введения площади его поверхности (S).
Например,
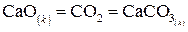
кинетическое уравнение для этой реакции:
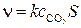
Особенности гетерогенных реакций:
1) Влияние площади реакционной поверхности на скорость реакции.
2) Скорость гетерогенной химической реакции зависит от скорости подвода реагента в зону химической реакции.
 2020-04-12
2020-04-12 129
129








