| Реагент | Формула | Катион | Продукт реакции |
| Ализарин | C14H6O2(OH)2 | Al3+ | Ярко-красный осадок |
| Бензидин | C12H8(NH2)2 | Cr3+ | Соединение синего цвета |
| Гексагидроксостбиат калия | K[Sb(OH)6] | Na+ | Белый осадок |
| Гексанитрокобальтат натрия | Na3[Co(NO2)]6 | K+ | Желтый осадок |
| Гексацианоферрат (II) калия | K4[Fe(CN)6] | Fe3+ | Темно-синий осадок |
| Cu2+ | Красно-бурый осадок | ||
| Гексацианоферрат(III) калия | K3[Fe(CN)6] | Fe2+ | Темно-синий осадок |
| Диметилглиоксим | C4N2H8O2 | Ni2+, Fe2+, Pd2+ | Ярко-красный осадок |
| Дитизон в хлороформе | C13H12N4S | Zn2+ | Малиново-красный раствор |
| Дихромат калия | К2Cr2O7 | Ba2+ | Желтый осадок |
| Мурексид | C8H6N6O6 | Ca2+ | Раствор красного цвета |
| Sr2+, Ba2+ | Раствор фиолетового цвета | ||
| Реактив Несслера | K2[HgI4] + KOH | NH4+ | Оранжевый осадок |
| Хромоген черный | C20H13O7N3S | Mg2+ | Раствор красного цвета |
Идентификация анионов. Анионы обычно классифицируют по растворимости солей, либо по окислительно-восстановительным свойствам.
Так многие анионы (SO42-, SO32-, CO32-. F-, PO43-, SiO32-, CrO42- и др.) имеют групповой реагент BaCl2 в нейтральной или слабо кислой среде, так как соли бария и этих анионов малорастворимы в воде. Групповым реагентом в растворе HNO3 на анионы Cl-, Br-, SCN-, CN-, S2-, ClO- и др. служит AgNO3. Классификация анионов по окислительно-восстановительным свойствам приведена в табл. 10.2.
Таблица 10.2.
Классификация анионов по окислительно-восстановительным свойствам
| Групповой реагент | Анионы | Групповой признак |
| Восстановители | ||
| Cl-, Br-, I-, SCN- | Обесцвечивание раствора | |
| KMnO4 + H2SO4 | C2O42-, S2-, SO32-, NO2- | |
| I2, крахмал + H2SO4 | S2-, SO32-, S2O32- | Обесцвечивание раствора |
| Окислители | ||
| KI + H2SO4 + (крахмал) | CrO42-, MnO4-, ClO- | Окрашивание раствора |
| ClO3-, NO2-, BrO3- | ||
| MnCl2 + HCl(конц) | NO3-, CrO42-, NO2-, ClO3- | Окрашивание раствора |
| [Fe(CN)6]3-, ClO-, MnO4- | ||
| Инертные | ||
| CO32-, SO42-, SiO32-, PO43-, F-, BO2- |
Отдельные ионы могут быть обнаружены с помощью тех или иных специфических реакций или реагентов. Например, при действии кислоты на анионы 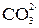 , протекает реакция с выделением углекислого газа:
, протекает реакция с выделением углекислого газа:
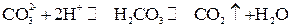 .
.
Таким образом, химическая идентификация вещества базируется в основном на реакциях осаждения, комплексообразования, окисления и восстановления, нейтрализации, при котором происходит выпадение белого или окрашенного осадка, изменение цвета раствора или выделение газообразных веществ.
Как и для катионов, имеются реагенты на те или иные анионы (табл.10.3.).
Таблица 10.3.
Некоторые реагенты для идентификации анионов
| Реагент | Формула | Ион | Продукты реакции |
| Антипирин, 5%-ный в H2SO4 | C6H5C3HON2(CH3)2 | NO2- | Раствор ярко-зеленого цвета |
| NO3- | Раствор ярко-красного цвета | ||
| Дифениламин в H2SO4 | (C6H5)2NH | NO3- | Раствор темно-синего цвета |
| Парамолибдат аммония в HNO3 | (NH4)6Mo7O24∙4H2O | PO43- | Желтый осадок |
| Родизонат бария | - | SO42- | Обесцвечивание раствора |
 2020-04-12
2020-04-12 156
156








