Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физические величины, называемые параметрами состояния. К ним относятся объём V, давление р, температура T.
Уравнение состояния идеального газа - уравнение, которое связывает между собой пять параметров идеального газа: массу (m), молярную массу (М), температуру (Т), давление (P) и объем (V). Это уравнение было получено экспериментально, но т.к. трудно провести эксперимент с изменением пяти параметров, то первоначально были установлены частные газовые законы, когда три параметра фиксировались, и определялась взаимосвязь двух других.
Всякое изменение состояния тела (системы тел) называется термодинамическим процессом.
Для изучения и сравнения различных термодинамических процессов их изображают графически.
Изопроцессами называют термодинамические процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров состояния системы.
Процесс, протекающий в газе, при котором объём остаётся постоянным, называется изохорным.
Закон Шарля: давление газа данной массы при постоянном объёме возрастает линейно с увеличением температуры.
 ;
;  ; (V=const, m=const).
; (V=const, m=const).
Процесс, протекающий в газе, при котором давление остаётся постоянным, называется изобарным.
Закон Гей-Люссака: объем газа данной массы при постоянном давлении возрастает линейно с увеличением температуры.

где t - температура газа по шкале Цельсия;
V0- объем данной массы газа при 0°С;
α -термический коэффициент объемного расширения.
Процесс, протекающий в газе, при котором температура остаётся постоянным, называется изотермическим.
Закон Бойля-Мариотта: давление газа данной массы при постоянной температуре убывает с увеличением объема.
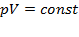 ;
; 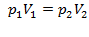 ; (T=const, m=const).
; (T=const, m=const).
Для произвольной массы m газа с молярной массой M справедливо уравнение Менделеева - Клапейрона:
pV= 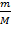 RT, где
RT, где
R=8,31  — молярная (универсальная) газовая постоянная.
— молярная (универсальная) газовая постоянная.
В другом виде уравнение состояния идеального газа можно записать в виде:
р=nkT,
где n= 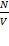 концентрация газа, то есть число частиц в единице объёма газа,
концентрация газа, то есть число частиц в единице объёма газа,
NA – постоянная Авогадро, k – постоянная Больцмана.
Закон Дальтона (давление смеси химически не взаимодействующих газов):

где Pi - парциальное давление, N -количество газов в смеси.
Задание 1. Ответьте на вопросы:
1. Какой процесс называется изотермическим?
2. Какой процесс называется изобарным?
3. Какой процесс называется изохорным?
4. При каких условиях справедлив закон Бойля – Мариотта? Гей – Люссака? Шарля?
 2020-04-07
2020-04-07 249
249








