Идеальный газ – математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия между молекулами можно пренебречь.
Основными термодинамическими параметрами идеального газа являются давление, температура и объем.
Связь между давлением газа и его микропараметрами задается основным уравнением молекулярно-кинетической теории, которое может быть представлено в виде (1-3):
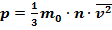 , (1)
, (1)
где p – давление газа;
m0 – масса молекулы газа;
n – концентрация молекул газа;
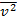 – средний квадрат скорости молекул газа.
– средний квадрат скорости молекул газа.
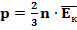 , (2)
, (2)
где 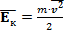 – средняя кинетическая энергия движения молекул газа.
– средняя кинетическая энергия движения молекул газа.
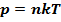 , (3)
, (3)
где 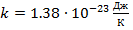 – постоянная Больцмана
– постоянная Больцмана
T – абсолютная температура
Абсолютная температура – мера средней кинетической энергии:
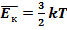 (для идеального газа)
(для идеального газа)
Связь между термодинамическими параметрами газа задается уравнением состояния (уравнением Менделеева-Клапейрона):
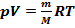 ,
,
где V – объем газа;
m – масса газа;
M – молярная масса;
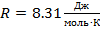 – универсальная газовая постоянная
– универсальная газовая постоянная
Из уравнения состояния следует вывод: связь между термодинамическими параметрами газа не изменяется при протекании термодинамических процессов:
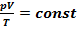 – объединенный газовый закон
– объединенный газовый закон
Внутренняя энергия идеального газа может быть определена по формуле:
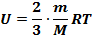
Способы изменения внутренней энергии газа:
1. Теплопередача (теплообмен): 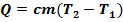
2. Работа: 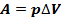 .
.
Если 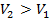 , то газ совершает работу (расширение). Если
, то газ совершает работу (расширение). Если 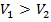 , то внешние силы совершают работу над газом (сжатие).
, то внешние силы совершают работу над газом (сжатие).
Таким образом: 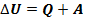 Или:
Или:
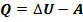 – первое начало термодинамики
– первое начало термодинамики
При неизменном значении одного из термодинамических параметров происходит изопроцесс. Характеристики изопроцессов представлены в Таблице 3-1.
Таблица 3-1 Изопроцессы
| Название процесса | Постоянный параметр | Газовый закон | Первое начало термодинамики |
| Изотермический | 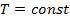
| 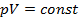
| 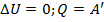
|
| Изобарный | 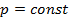
| 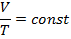
| 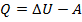
|
| Изохорный | 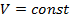
| 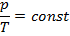
| 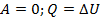
|
 2020-04-12
2020-04-12 127
127








