Из принципиальной схемы видно, что производство серной кислоты контактным методом из флотационного колчедана можно разделить на четыре основные стадии: получение сернистого ангидрида; очистка газов от примесей; окисление сернистого ангидрида на катализаторе; абсорбция серного ангидрида.
Получение сернистого ангидрида. Флотационный колчедан содержит кроме пирита сульфиды других металлов, небольшое количество мышьяка, селена и другие примеси. При нагревании пирита до 500°С происходит диссоциация пирита на сульфид железа и серу:
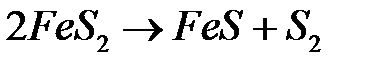 .
.
При этом сера быстро сгорает в газовой фазе:
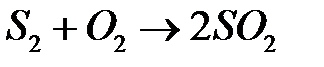 .
.
При дальнейшем повышении температуры сульфид железа окисляется по уравнению:
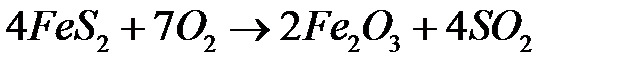 .
.
Процесс обжига флотационного колчедана может быть описан с достаточной степенью точности с помощью модели частицы с невзаимодействующим ядром (Рис. 6.2). В зависимости от условий обжига каждая из стадий, составляющих эту модель (кинетика, внешняя и внутренняя диффузия) могут лимитировать процесс.
Рис. 6.2. Схема окисления колчедана кислородом воздуха:
1 – ядро, состоящее из колчедана (FeS2); 2 – зола, состоящая из оксида железа (Fe2О3); 3 – пограничный слой воздуха (О2); 4 – внешнедиффузионная область; 5 – внутридиффузионная область; 6 – химическая реакция на поверхности 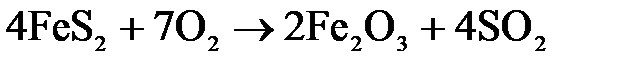 . .
|
В соответствии с ранее установленными зависимостями скорость процесса обжига пирита FeS2 определяется скоростью окисления односернистого железа FeS, так как разложение пирита на FeS и S2 и окисление серы до SO2 протекают со значительно большей скоростью, чем окисление FeS. Поэтому влияние различных факторов на скорость горения пирита исследуют на реакции окисления FeS. При этом было установлено, что при низких температурах процесс протекает в кинетической области (кипящий слой) и время контакта τ может быть описано уравнением:
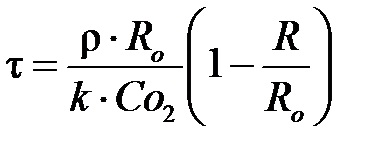 , ,
| (6.1) |
где Ro и R – начальный и конечный радиус ядра; ρ – плотность FeS; k – константа скорости химической реакции; 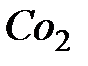 – концентрация O2 в газовой фазе.
– концентрация O2 в газовой фазе.
Из этого уравнения следует, что если процесс протекает в кинетической области, то для его интенсификации (уменьшения времени контакта) необходимо уменьшать размер частиц FeS2 Ro, увеличивать концентрацию кислорода в воздухе и, по возможности, процесс проводить при более высокой температуре, но при условии, что она не приводит к переходу его в диффузионную область.
Однако на практике процесс обжига колчедана ведут при температуре около 800°С. При этой температуре процесс протекает в диффузионной области и в первом приближении для его описания можно воспользоваться следующими уравнениями:
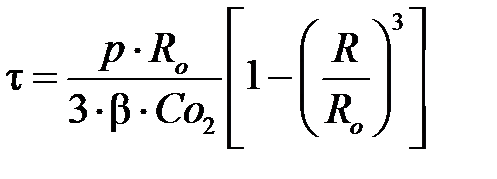 , ,
| (6.2) |
где β – коэффициент скорости массопередачи по газу, т.е. диффузией.
Уравнение (6.2) отражает время контакта газа (воздуха) с частицами FeS если процесс протекает в области внешней диффузии. Если же процесс окисления FeS лимитируется внутренней диффузией, то
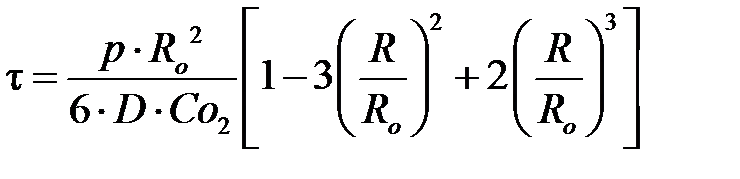 , ,
| (6.3) |
где D – коэффициент диффузии газа (воздуха) через слой золы.
Следовательно, для интенсификации процесса, протекающего в диффузионной области, целесообразно повышать скорость газового потока или уменьшать размеры частиц FeS. Однако применения этих мощных факторов интенсификации процесса окисления пирита ограничены выносом частиц из реактора.
Для обжига флотационного колчедана применяются печи различных конструкций: механические печи, печи пылевидного обжига и печи с кипящим слоем флотационного колчедана. В механических печах пиритный концентрат находится на нескольких полках и сгорает по мере перемешивания его гребками с одной полки на другую (Рис. 6.3 а).
Рис 6.3. Принципиальные схемы аппаратов для проведения процессов обжига флотационного колчедана:
а – механическая печь с перемешивающим устройством; б – печь пылевидного обжига; в – печь обжига с кипящим слоем частиц пиритного концентрата.
В печах пылевидного обжига частицы пиритного концентрата сгорают во время падения в полой камере (Рис. 6.3 б).
В печах обжига в кипящем слое частицы пиритного концентрата поддерживаются во взвешенном состоянии поступающим снизу воздухом и сгорают при интенсивном перемешивании.
Механические полочные печи и печи пылевидного обжига малоинтенсивные, поэтому в сернокислотных цехах устанавливают главным образом печи кипящего слоя (КС).
На выходе из печи КС в газе содержится до 300 г·м3 пыли. Наличие пыли в газе, поступающем на окисление SO2 в SO3, недопустимо, так как пыль засоряет аппаратуру, загрязняет кислоту и снижает активность катализатора. Очистка газа осуществляется в два этапа (Рис. 6.4).
Рис. 6.4. Схема печного отделения производства серной кислоты:
1 – нагнетатель; 2 – печь КС; 3 – котел-утилизатор; 4 – циклон;
5 – сухой электрофильтр.
После котла-утилизатора газ поступает в циклон, где осаждается основная часть пыли (содержание пыли снижается до 10-20 г·м-3). Из циклона газ направляют в сухой электрофильтр, состоящий из четырех последовательных ступеней. Здесь достигается высокая степень очистки газа – в нем остается пыли 0,05-0,12 г·м-3.
Очистка обжигового газа. После выделения пыли обжиговый газ подвергается специальной очистке для удаления примесей, присутствие которых недопустимо в газе, поступающем на катализатор, так как они снижают его активность – это остатки пыли, мышьяк, фтор и др. Такая очистка проводится в башнях с насадкой и в полых башнях (Рис.6.5), орошаемых серной кислотой различной концентрации.
Обжиговый газ направляется в первую промывную полую башню 1, в верхней части которой разбрызгивается 50%-ная серная кислота; затем газ проходит вторую промывную башню с насадкой, орошаемой 10-20%-ной серной кислотой. В результате соприкосновения газа с кислотой он охлаждается, при этом из него выделяются остатки пыли, соединения мышьяка и селена, а также серный ангидрид и некоторые другие примеси. Однако при охлаждении часть серного ангидрида образует пары серной кислоты, которые конденсируются в объеме в виде мельчайших капель кислоты (туман). Для выделения этого тумана газ направляют в мокрые электрофильтры, а затем в сушильные башни для выделения влаги. Во второй промывной башне газ практически полностью насыщается парами воды, поэтому содержание водяных паров в газе, поступающем в сушильные башни, велико и оно там больше, чем выше температура газа во второй промывной башне и ниже концентрация кислоты, орошающей эту башню.
Осушка газа производится в насадочной (скрубберной) башне, где пары воды абсорбируются 93-95%-ной серной кислотой, орошающей эти башни. Содержание влаги в газе, выходящем из сушильных башен, не должно превышать 0,01% (об.).
Процесс осушки газа рассчитывают по уравнению, которое для практических расчетов имеет вид:
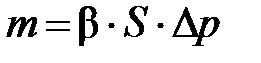 , ,
| (6.4) |
где m – масса паров воды, поглощаемых из газа (скорость процесса); β – коэффициент массопередачи; S – поверхность соприкосновения фаз (поверхность насадки); Δ p – средне логарифмическая разность давлений паров воды в начале и в конце процесса (движущая сила процесса).
Рис. 6.5. Схема очистного отделения:
1,2 – первая и вторая промывные башни; 3 – мокрый электрофильтр; 4 – сушильная башня; 5 – холодильники кислоты.
Коэффициент массопередачи определяют по уравнению:
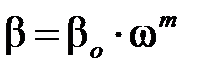 , ,
| (6.5) |
где ω – фиктивная скорость газа в башне (без учета в ней насадки); β о – константа, численно равная β при ω=1; m – коэффициент равный 0,5 при ламинарном потоке и 0,8 при турбулентном потоке.
Окисление сернистого ангидрида. Окисление сернистого ангидрида проводится в присутствии ванадиевого катализатора. Основные характеристики реакции окисления
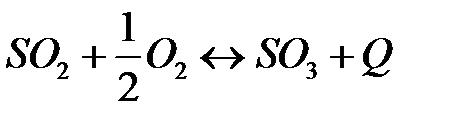
описываются следующими уравнениями. Скорость реакции окисления на ванадиевом катализаторе (V2O5) в псевдоожиженном слое определяется уравнением:
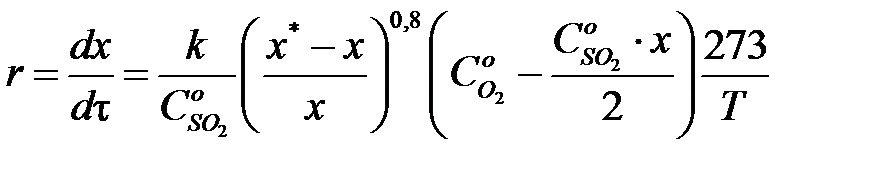 , ,
| (6.6) |
где x – степень превращения, доли; τ – время контакта, с; k – константа скорости реакции, с-1·атм-1; 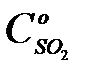 - начальная концентрация сернистого ангидрида, доли;
- начальная концентрация сернистого ангидрида, доли; 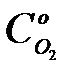 - начальная концентрация О2, доли.
- начальная концентрация О2, доли.
Константа равновесия процесса окисления имеет вид:
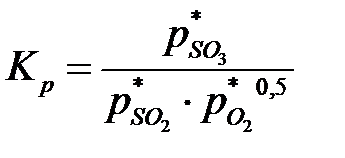 , ,
| (6.7) |
где Kp в интервале температур 390-450°С можно определить по уравнению:
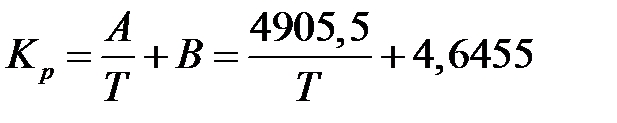 . .
| (6.8) |
Равновесная степень превращения может быть описана выражением:
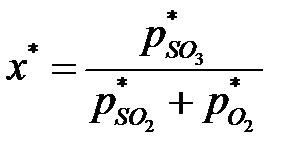 , ,
| (6.9) |
где 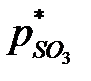 ,
, 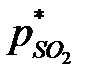 ,
, 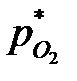 - равновесные парциальные давления SO3, SO2 и O2.
- равновесные парциальные давления SO3, SO2 и O2.
Из уравнения (6.7) следует:
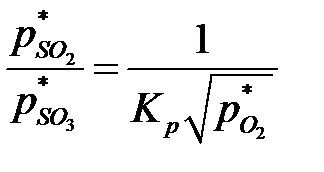 . .
| (6.10) |
Подставив это значение в уравнение (6.9), найдем:
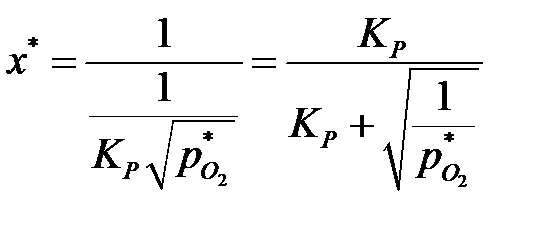 . .
| (6.11) |
Тепловой эффект в интервале температур 400-700°С можно рассчитать по уравнению:
 . .
| (6.12) |
Анализ вышеприведенных уравнений показывает, что с одной стороны с увеличением температуры скорость окисления SO2 будет увеличиваться (k выражается уравнением Аррениуса), а с другой с повышением температуры равновесная степень превращения будет уменьшаться (реакция является экзотермической). Поэтому процесс окисления SO2 в SO3 целесообразно проводить по линии оптимальных температур (рис. 6.6).
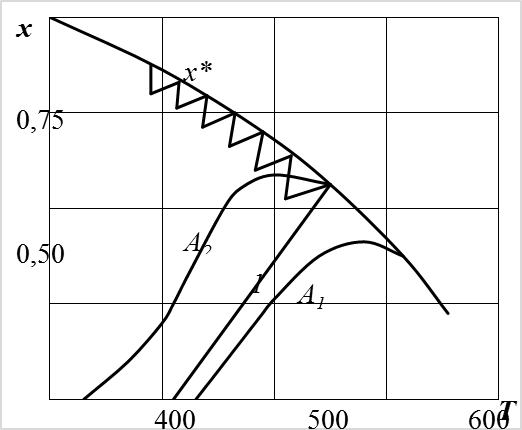
| Рис. 6.6. Зависимость степени превращения x для экзотермической обратимой реакции от Т для катализаторов различной активности А: А1<А2; 1 – адиабата. |
Процесс надо начинать при высокой температуре, когда обеспечивается большая скорость, а затем с целью достижения высокой степени превращения, снижать температуру, ведя процесс по линии оптимальных температур. На практике поступают следующим образом. Температуру газа на входе в первый слой катализатора поддерживают равной 440°С (несколько выше температуры зажигания, которая равна 420°С). За счет тепла реакции температура повышается по адиабате в соответствии с уравнением:
 . .
| (6.13) |
В дальнейшем процесс следует вести по линии оптимальных температур (ЛОТ), однако поддержание оптимального режима (в строгом соответствии с ЛОТ) связано с большими трудностями, поэтому создают режим, приближающийся к оптимальному.
| Рис. 6.7. Схема контактного отделения производства серной кислоты: 1 – нагнетатель; 2 – теплообменник; 3 – контактный аппарат. |
Для поддержания такого режима в контактном аппарате КС, охлаждающие элементы (теплообменники) размещают в самом слое массы катализатора (рис. 6.7). Сюда направляют холодную газовую смесь или воду, или какой-либо хладагент.
Абсорбция серного ангидрида. Последней стадией процесса получения серной кислоты является извлечение серного ангидрида из газовой смеси и превращение его в серную кислоту. Этот процесс проводят в башне с насадкой. В нижнюю часть башни направляется газовая смесь, а на верхнюю часть подается серная кислота, которая стекая вниз смачивает поверхность насадки (рис. 6.8).
При соприкосновении газовой смеси с серной кислотой ангидрид абсорбируется ею, а затем взаимодействует с содержащейся в кислоте водой по реакции:
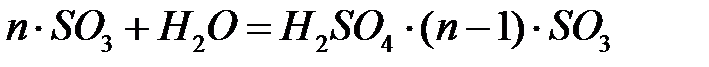 .
.
В зависимости от количественного соотношения воды и серного ангидрида (значения n) получают серную кислоту различной концентрации. При n =1 образуется моногидрат (100%-ная серная кислота); при n <1 образуется водный раствор кислоты, т.е. разбавленная серная кислота; при n >1 образуется олеум H2SO4· x ·SO3(где x = n -1).
| Рис. 6.8. Схема абсорбционного отделения производства серной кислоты: 1 – абсорбер; 2 – сборник; 3 – холодильник; 4 – насос. |
После абсорбции SO3 газовая смесь с непоглощенным серным ангидридом удаляется в атмосферу. Для уменьшения потерь SO3 с отходящими газами, а также для защиты атмосферы, степень поглощения серного ангидрида в абсорбционном отделении должна быть возможно большая. Полнота абсорбции зависит от концентрации, применяемой для абсорбции кислоты. Многочисленными опытами было показано, что оптимальным абсорбентом является 98,3%-ная кислота.
 2020-04-12
2020-04-12 459
459








