План
Лекції з навчальної дисципліни
Ф І З И К А
Тема: "ГАЗИ У ЗОВНІШНЬОМУ СИЛОВОМУ ПОЛІ"
Вступ
Основні закони ідеального газу, одержані експериментально, успішно пояснюються, при певних умовах, молекулярно-кінетичною теорією газів. Причому розподіл молекул по швидкостям характеризуються функцією Максвелла.
Атмосфера Землі, при певних умовах, може розглядатись як ідеальний газ, який знаходиться в полі тяжіння Землі і це, безперервно, впливає на поводження атомів і молекул газової оболонки Землі. Важливо знати цей вплив і будову атмосфери, оскільки в верхніх шарах існують шари з великою концентрацією зарядів, які впливають на розповсюдження радіохвиль навколо Землі. Отже ці питання мають велике практичне значення для радіозв’язку. Рух молекул в газі залежить також і від тиску. При певних умовах виникає вакуум, з певними особливостями, які використовуються на практиці. Ці, та питання термодинаміки важливо вияснити на занятті для загального розвитку слухачів.
Ідеальний газ в зовнішньому силовому полі. Розподіл Больцмана. Барометрична формула
Функція розподілу молекул під дією поля зовнішніх сил (в залежності від їх потенціальної енергії) знайшов Больцман. Різниця тисків на рівнях, які відрізняються на високу Dh, дорівнює:
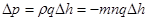 .
.
Перейшовши до нескінченно малих, маємо:
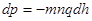 .
.
З другого боку, згідно основного рівняння молекулярно-кінетичної теорії газу, p =nkT, звідки знаходимо:
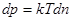 .
.
Отже,
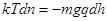
або
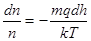 .
.
Потенціюємо і одержуємо:
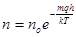 .
.
В загальному випадку розподіл молекул по енергіям в потенціальному полі буде таким:
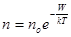
Це і є закон Больцмана, який показує, що при даній температурі Т концентрація частинок n зростає їх зменшенням енергії W, тобто що частинки концентруються в місцях з меншою потенціальною енергією – тобто в місцях стійкої рівноваги. Але із збільшенням Т при сталій енергії W різниця концентрації п і по згладжується. Таким чином сили поля «намагаються вдержати» частинки по всьому об’єму. При T® 0 молекули атмосфери упали б на Землю. Існування атмосфери можливе завдяки тепловому рухові молекул. Так як p =nkT, а 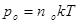 і вважаючи T = const із закону Больцмана маємо:
і вважаючи T = const із закону Больцмана маємо:
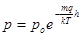 або
або 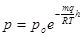
це барометрична формула, з якої витікає, що тиск атмосфери із збільшенням висоти зменшується по експоненціальному закону (рис. 1).
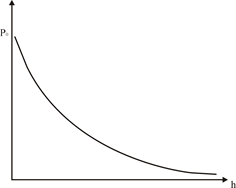
Рис. 1
Закон Больцмана характеризує розподіл частинок в будь-якому силовому полі і використовується для електронів в електричному полі в металах, напівпровідниках і т.д.
 2020-04-20
2020-04-20 157
157







