Сейчас известно несколько десятков природных пептидных гормонов, и список их постепенно пополняется.
Благодаря широкому использованию методов бурно развивающейся белковой химии в последние годы ряд пептидных гормонов получен в гомогенном состоянии, изучен их аминокислотный состав, выянена первичная (а в случае белковых гормонов - вторичная, третичная и четвертичная) структура и некоторые из них приготовлены синтетическим путём. Более того, большие успехи, достигнутые в области химического синтеза пептидов, позволили искусственно получить множество пептидов, являющихся изомерами или аналогами натуральных пептидов. Изучение гормональной активности последних принесло исключительно важную информацию о взаимосвязи структуры пептидных гормонов с их функцией.
Важнейшими пептидными гормонами являются тиреотропин, инсулин, глюкагон, гастрин, окситоцин, вазопрессин.
Тиреотропин
Тиреотропин -белок, выделяемый передней долей гипофиза. Он предствляет собой гликопротеин с М = 28300, составленный из двух неравных субъединиц (М = 13600 и 14 700), исключетельно богатых дисульфидными мостиками (5 и 6 соответственно). Первичная структура тиреотропина быка и свиньи выясненаю При недостатке тиреотропина (гипофункция гипофиза) ослабляется деятельность щитовидной железы, она уменьшается в размерах, а содержание в крови выделяемого ею гормона - тироксина - сокращается вдвое.
Таким образом, тиреотропин стимулирует деятельность щитовидной железы. В свою очередь, выделение тиреотропина регулируется по принципу обратной связи гормонами щитовидной железы. Следовательно, деятельность двух упомянутых желез внутренней секреции тонко координирована.
Введение тиреотропина вызывает множественные сдвиги в обмене веществ: через 15-20 минут повышается секреция гормонов щитовидной железы и усиливается поглощение ею йода, необходимого для синтеза этих гормонов; повышается поглощение кислорода щитовидной железой, возрастает окисление глюкозы, активируется обмен фосфолипидов и новообразование РНК. Сейчас выяснено, что механизм действия тиреотропина, как и многих других пептидных гормонов, сводится к активированию аденилатциклазы, расположенной в непосредственной близости от рецепторного белка, с которым связывается тиреотропин. Как следствие этого, в щитовидной железе ускоряется ряд процессов, в том числе и биосинтез тиреоидных гормонов. [3]
Инсулин
Инсулин -белок, вырабатываемый в β-клетках поджелудочной железы. Его строение детально изучено. Инсулин был первым белком, у которого Ф. Сангером была выяснена первичная структура. Он же явился первым белком, полученным путем химического синтеза.
Впервые наличие в железе гормона, влияющего на углеводный обмен, было отмечено Мерингом и О. Миньковским (1889). Позднее Л.В. Соболев (1901) установил, что источником инсулина в поджелудочной железе служит её островковая часть, в связи с чем в 1909 году этот гормон, не будучи ещё индивидуализирован, получил наименование - инсулин (от лат. insula - остров). В 1992 году Ф. Бантинг и Г. Бест впервые приготовили активный препарат инсулина, а к 1926 году были разработаны способы его выделения в высокоочищенном состоянии, в том числе в виде кристаллических препаратов, содержащих 0,36% Zn.
Инсулин синтезируется в бета-клетках островков Лангерганса обычным механизмом синтеза белка. Трансляция инсулина начинается на рибосомах, связанных с эндоплазматическим ретикулумом, с образования препрогормона инсулина. Этот исходный препрогормон с молекулярной массой 11500 в эндоплазматическом ретикулуме расщепляется до проинсулина с молекулярной массой около 9000. Далее в аппарате Гольджи большая его часть дробится на инсулин, упаковывающийся в секреторные гранулы, и пептидный фрагмент. Однако почти 1/6 часть конечного секретируемого продукта остается в форме проинсулина. Проинсулин является неактивной формой гормона.
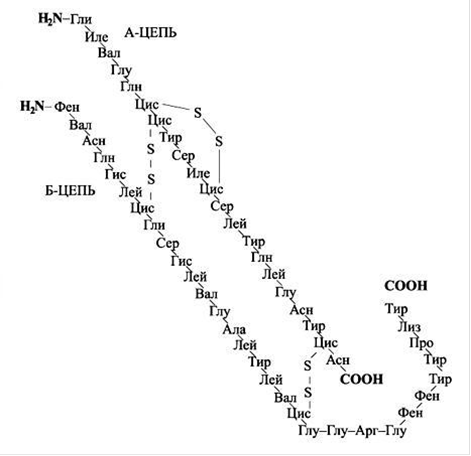
Молекулярная масса кристаллического инсулина равна 36 000. Его молекула представляет собой мультимер, составленный из шести протомеров и двух атомов Zn. Протомеры образуют димеры, которые взаимодействуют с имидазольными ядрами радикалов гис10 цепи B и способствуют их агретации в гексамер. Распадаясь, мультимер дает три субчастицы с молекулярной массой 12 000 каждая. В свою очередь, каждая субчастица расщепляется на две равные части с М = 6000. Все перечисленные модификации инсулина - протомер, дамер и гексамер - обладают полной гормональной активностью. Поэтому часто молекулу инсулина отождествляют с протомером, обладающим полной биологической активностью (М = 6000), тем более, что в физиологических условиях инсулин существуют в мономерной форме. Дальнейшее фрагментирование молекулы инсулина (с М = 6000) на цепь А (из 21 аминокислотного остатка) и цепь В (из 30 аминокислотных остатков) ведет к утрате гормональных свойств.
Инсулины, выделенные из поджелудочной железы различных животных, почти идентичны по первичной структуре. При недостаточном уровне биосинтеза инсулина в поджелудочной железе человека (в норме ежесуточно синтезируется 2 мг инсулина) развивается характерное заболевание - диабет, или сахарное мочеизнурение. При этом повышается содержание глюкозы в крови (гипергликемия) и растет выведение глюкозы с мочой (глюкозурия). Одновременно развивается различные вторичные явления - падает содержание гликогена в мышцах, замедляется биосинтез пептидов, белков и жиров, нарушается минеральный обмен и т.п.
Введение инсулина путем инъекции или per os (в рот) в виде препарата, инкапсулированного в липосомы, вызывает противоположный эффект: понижение содержания глюкозы в крови, повышение запасов гликогена в мышцах, усиление анаболических процессов, нормализацию минерального обмена и т.д. Все перечисленные выше явления представляют результат изменения под воздействием инсулина проницаемости для глюкозы клеточных мембран, на поверхности которых выявлены высоко - и низкоаффинные Ca2+ - зависимые инсулиновые рецепторы. Повышая уровень проникновения глюкозы внутрь клетки и субклеточных частиц, инсулин усиливает возможности её использования в тех или иных тканях, будь то биосинтез из неё гликогена или дихотомический или апотомический её распад.
При взаимодействии инсулина с рецептором клеточной мембраны возбуждается активность протеинкиназного домена инсулинового рецептора, что сказывается на внутриклеточном метаболизе углеводов, липидов и белков. Для инсулина не типичен аденилатциклазный механизм действия. [3] [7]
Глюкагон
В поджелудочной железе, помимо инсулина, вырабатывается другой гормон, влияющий на обмен углеводов - глюкагон.
Это 29 - членный пептид, синтезирующийся в α-клетках островской части поджелудочной железы. Первое упоминание об этом гормоне восходит к 1923 г., когда И. Мурлин с сотрудниками обнаружил его присутствие в препаратах инсулина. В 1953 г.Ф. Штрауб получил глюкагон в виде гомогенного кристаллического препарата, а несколько позже была выяснена его первичная структура. Полный синтез глюкагона осуществлён в 1968 году (Э. Вюнш и сотрудники). По данным рентгеноструктурного анализа (Т. Бландел), молекула глюкагона преимущественно находится в α-спиральной конформации и склонна к образованию олигомеров.
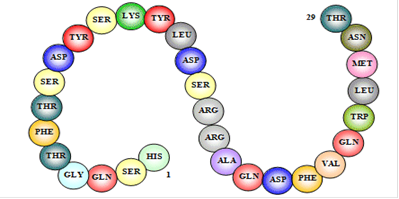
Первичная структура глюкагонов человека и животных оказалась идентичной; исключение составляет только глюкагон индюка, у которого вместо аспарагина в положении 28 содержится серин. Особенностью структуры глюкагона является отсутствие дисульфидных связей и цистеина. Глюкагон образуется из своего предшественника проглюкагона, содержащего на С-конце полипептида дополнительный октапептид (8 остатков), отщепляемый в процессе постсинтетического протеолиза. Имеются данные, что у проглюкагона, так же как и у проинсулина, существует предшественник - препроглюкагон (мол. масса 9000), структура которого пока не расшифрована.
По биологическому действию глюкагон, как и адреналин, относятся к гипергликемическим факторам, вызывает увеличение концентрации глюкозы в крови главным образом за счёт распада гликогена в печени. Органами-мишенями для глюкагона является печень, миокард, жировая ткань, но не скелетные мышци. Биосинтез и секреция глюкагона контролируется главынм образом концентрацией глюкозы по принципу обратной связи. Таким же свойством обладают аминокислоты и свободные жирные кислоты. На секрецию глюкагона оказывает влияние также инсулин и инсулиноподобные факторы роста.
В механизме действия глюкагона первичным является связывание со специфическими рецепторами мембраны клеток, образовавшийся глюкагонрецепторный комплекс активирует аденилатциклазу и соответственно образование цАМФ. Последний, являясь универсальным эффектором внутриклеточных ферментов, активирует протеинкиназу, которая в свою очередь фосфорилирует киназу фосфорилазы и гликогенсинтазу. Фосфорилирование первого фермента способствует формированию активной гликогенфосфорилазы и соответственно распаду гликогена с образованием глюкозо-1-фосфата, в то время как фосфорилирование гликогенсинтазы сопровождается переходом её в неактивную форму и соответственно блокированием синтеза гликогена. Общим итогом действия глюкагона является ускорение распада гликогена и торможение его синтеза в печени, что приводит к увеличению концентрации глюкозы в крови.
Гипергликемический эффект глюкагона обусловлен, однако, не только распадом гликогена. Имеются бесспорные доказательства существования глюконеогенетического механизма гипергликемии, вызванной глюкагоном. Установлено, что глюкагон способствует образованию глюкозы из промежуточных продуктов обмена белков и жиров. Глюкагон стимулирует образование глюкозы из аминокислот путём индукции синтеза ферментов глюконеогенеза при участии цАМФ, в частности фосфоенолпируваткарбоксиназы - ключевого фермента этого процесса. Глюкагон в отличие от адреналина тормозит гликолитический распад глюкозы до молочной кислоты, способствуя тем самым гипергликемии. Он активирует опосредственно через цАМФ липазу тканей, оказывая мощный липолитический эффект. Существует и различия в физиологическом действии: в отличие от адреналина глюкагон не повышает кровяного давления и не увеличивает частоту сердечных сокращений. Следует отметить, что, помимо панкреатического глюкагона, в последнее время доказано существование кишечного глюкагона, синтезирующегося по всему пищеварительному тракту и поступающего в кровь. Первичная структура кишечного глюкагона пока точно не расшифрована, однако в его молекуле открыты идентичные N-концевому и среднему участкам панкреатического глюкагона аминокислотные последовательности, но разная С-концевая последовательность аминокислот.
Таким образом, панкреатические островки, синтезирующие два противоположного действия гормона - инсулин и глюкагон, выполняют ключевую роль в регуляции веществ на молекулярном уровне. [3] [4] [2]
Гастрин
Гастрин продуцируется G-клетками, локализованными в слизистой антральной части желудка и в меньшем количестве - в слизистой двенадцатипёрстной кишке.
Существует три основных естественных формы гастрина: "большой гастрин", или гастрин-34 - полипептид из 34 аминокислот, "малый гастрин", или гастрин-17, состоящий из 17 аминокислот, и "минигастрин", или гастрин-14, состоящий из 14 аминокислот.
Он более гетерогенен по размерам молекул, чем какой-либо другой желудочно-кишечный гормон. Кроме того, каждая из форм гастрина существует в сульфированном и несульфированном виде (по единственному остатку тирозина). С-концовые 14 аминокислот в гастрине 34, гастрине 17 и гастрине 14 идентичны. Гастрин 34 присутствует в крови в большем количестве, чем гастрин 17. Вероятно, это объясняется тем, что период его полужизни в плазме (15 мин) в 5-7 раз превышает таковой для гастрина 17. Последний, по-видимому, выступает в роли главного стимулятора секреции кислоты желудком, которая регулируется по механизму отрицательной обратной связи, так как закисление содержимого антральной области желудка снижает секрецию гастрина. Гастрин также стимулирует секрецию желудка. За биологическую активность ответствен С-конец гормона, С-концевой пентапептид вызывает полный спектр физиологических эффектов гастрина 17, но в расчёте на единицу массы обладаю лишь 1/10 его биологической активности. [5]
 2020-04-20
2020-04-20 257
257








