Задача. Какой объём водорода выделится при действии избытка соляной кислоты на 6г цинка?
6г Х
Zn + 2HCl = ZnCl2 + H2↑
1 моль 1 моль
65г 22,4л
1) Mr (Zn)= 65
1 моль цинка весит 65г.
2) 6г------------Х
65г--------22,4л
Х = (22,4л · 6г) / 65г = 2,1 л.
Ответ: выделится 2,1 л водорода.
Основные источники:
Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического
профиля: учебник для студ. учреждений сред.проф. образования. — М., 2016.
Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественнонаучного профиля: учебник для студ. учреждений сред.проф. образования. — М., 2014..
Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического и естественнонаучного профилей: учебник для студ. учреждений сред.проф. образования. М., 2014.Журналы: «Химия и жизнь»
«Химия в школе»
«Наука и жизнь»
Дополнительная литература:
Габриелян О. С. и др. Химия для профессий и специальностей технического профиля
(электронное приложение).
Интернет-ресурсы
Всероссийская олимпиада для школьников "Покори Воробьевы горы". [ Электронный ресурс ] URL https://pvg.mk.ru(Дата обращения 17.05.2018)
Химия. Образовательный сайт для школьников. Экспериментальный учебник по химии для 8 и 11 классов средней школы. Общая и неорганическая химия. [ Электронный ресурс ] URL http://hemi.wallst.ru (Дата обращения 17.05.2018)
Электронный учебник, информация о ЕГЭ,тесты по химии,примеры решения задач, история химии, занимательные опыты, биографии химиков, номенклатура, кинетика реакций, портреты химиков, химия в быту,витамины, химические таблицы, классификация реакции. [ Электронный ресурс ] URL http://allhimikov.ru (Дата обращения 17.05.2018)
Информация о химических факультетах, вузах, ассоциациях. Электронная библиотека. Базы данных по химии. Сведения о конференциях, семинарах, конкурсах, олимпиадах. [ Электронный ресурс ] URL http://www.chem.msu.su (Дата обращения 17.05.2018)
Интернет-издание для учителей «Естественные науки». [ Электронный ресурс ] URL http://enauki.prosv.ru (Дата обращения 17.05.2018)
Методическая газета «Первое сентября». [ Электронный ресурс ] URL https://1сентября.рф (Дата обращения 17.05.2018)
Журнал «Химия в школе», aрхив аннотация статей журнала с 2010 года. Сведения о подписке. Редакционная коллегия. [ Электронный ресурс ] URL http://www.hvsh.ru (Дата обращения 17.05.2018)
журнал «Химия и жизнь [ Электронный ресурс ] URL http://www.hij.ru (Дата обращения 17.05.2018)
Электронный журнал «Химики и химия». [ Электронный ресурс ] URL http://chemistry-chemists.com (Дата обращения 17.05.2018)
Приложение 1
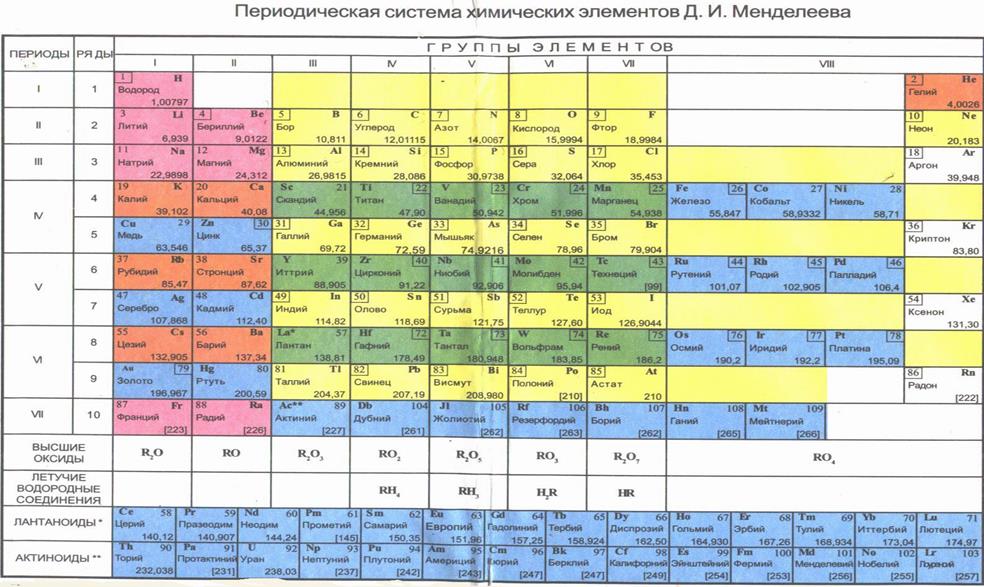
Приложение 2
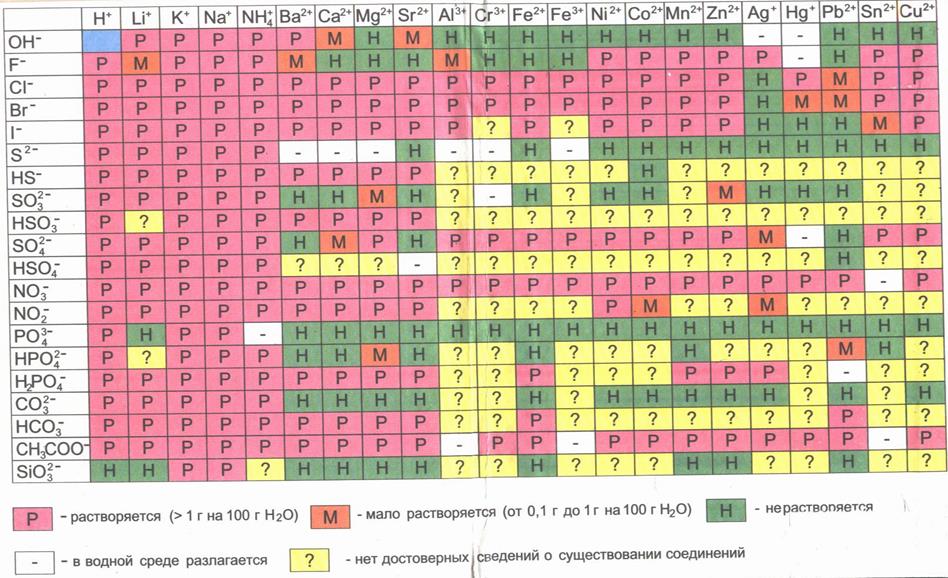
Приложение 3
| Название кислоты | Формула кислоты | Кислотный остаток | Формула соли | Название соли |
| Азотистая | HNO2 | NO2- | КNO2 | Нитрит калия |
| Азотная | HNO3 | NO3- | КNO3 | Нитрат калия |
| Бромоводородная | HBr | Br- | КBr | Бромид калия |
| Иодоводородная | HI | I- | КI | Иодид калия |
| Кремниевая | H2SiO3 | SiO32- | К2SiO3 | Силикат калия |
| Марганцовая | HMnO4 | MnO4- | КMnO4 | Перманганат калия |
| Марганцовистая | H2MnO4 | MnO42- | К2MnO4 | Манганат калия |
| Серная | H2SO4 | SO42- | К2SO4 | Сульфат калия |
| Сернистая | H2SO3 | SO32- | К2SO3 | Сульфит калия |
| Сероводородная | H2S | S2- | К2S | Сульфид калия |
| Угольная | H2CO3 | CO32- | К2CO3 | Карбонат калия |
| Фосфорная (орта) | H3РO4 | РO43- | К3РO4 | Ортофосфат калия |
| Фосфорная (мета) | HРO3 | РO3- | КРO3 | Метафосфат калия |
| Хлорноватистая | HClO | ClO- | КClO | Гипохлорит калия |
| Хлористая | HClO2 | ClO2- | КClO2 | Хлорит калия |
| Хлорноватая | HClO3 | ClO3- | КClO3 | Хлорат калия |
| Хлорная | HClO4 | ClO4- | КClO4 | Перхлорат калия |
| Хлороводородная (соляная) | HCL | CL- | КCL | Хлорид калия |
| Хромовая | H2CrO4 | CrO42- | К2CrO4 | Хромат калия |
| Хромистая | HCrO2 | CrO2- | КCrO2 | Хромит калия |
| Двухромовая | H2Cr2O7 | Cr2O72- | К2Cr2O7 | Дихромат калия |
Приложение 4
| Понятие | Определение | Примеры |
| Средние или нормальные соли | Продукты полного замещения атомов водорода на металл | ВаSO4 - сульфат бария, СаСО3 – карбонат кальция |
| Кислые соли | Продукты неполного замещения атомов водорода на металл | NаНСОз – гидрокарбонат натрия, МgНSО4 – гидросульфат магния |
| Основные соли | Соли, которые кроме ионов металла и кислотного остатка содержат гидроксо-группы | А1(ОН)2С1 – дигидроксихлорид алюминия, [Са(ОН)]2С03 – гидроксикарбонат кальция |
| Двойные соли | Соли, в которых атомы водорода многоосновной кислоты замещены разными металлами | КNаSО4 – натриевокалиевые квсцы. |
| Комплексные соли | Соли, содержащие комплексный ион | [Аg(NНз)2]Cl – сульфат диаминсеребра (I), К4[Fе(СN)6] – гексацианоферрат калия. |
Приложение 5
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
 2020-04-07
2020-04-07 664
664







