С философской точки зрения всё то, из чего состоит Мир, называется материей, а под веществом понимается форма существования материи, отражающая её дискретность, прерывность, корпускулярность. Исторически сложилось так, что в естествознании под веществом понимали систему, состоящую из элементов, которые были названы атомами. Атом - простое тело, неразложимое химическим путём на ещё более простые. Долгое время атомы считались неделимыми или элементарными первокирпичиками материи. В результате такого подхода Д.И. Менделеев создал периодическую систему элементов вещества.
Вещество, понимаемое и далее как совокупность атомов, характеризуется определёнными физическими свойствами, например, агрегатным состоянием, температурой плавления, температурой кипения. Вещество может находиться в трёх агрегатных состояниях: газообразном, жидком, твёрдом. В газообразном состоянии связи между элементами вещества состоят в отталкивании их друг от друга, и газ не сохраняет ни объём, ни форму, а равномерно заполняет любой сосуд. В жидком агрегатном состоянии силы отталкивания и притяжения между элементами вещества уравновешивают друг друга, поэтому жидкость обладает текучестью и сохраняет свой объём, но не сохраняет форму. В твёрдом агрегатном состоянии элементы вещества притягиваются друг к другу, и тело сохраняет как объём, так и форму. Если газ представляет собой совокупность практически самостоятельных элементов, то в конце цепочки превращений вещества все его элементы жёстко связаны в один объект - твёрдое физическое тело.
 Если сопоставить перечисленные выше свойства различных фазовых состояний вещества с математическими символами, то очевидно, что отталкивание в газах есть полная противоположность притяжению в твёрдых телах и, соответственно, этим фазовым состояниям могут быть присвоены условные обозначения в виде противоположных символов (-1) и (+1). Тогда жидкое состояние вещества, которое соединяет в себе и то и другое, и поэтому не является ни тем, ни другим, может быть сопоставлено с математическим символом 0, полученным как результат сложения первых двух: (-1) + (1)=0. При этом три различных фазовых состояния вещества могут быть изображены на числовой оси тремя точками, принадлежащими соответственным числовым значениям (см. рис. 6).
Если сопоставить перечисленные выше свойства различных фазовых состояний вещества с математическими символами, то очевидно, что отталкивание в газах есть полная противоположность притяжению в твёрдых телах и, соответственно, этим фазовым состояниям могут быть присвоены условные обозначения в виде противоположных символов (-1) и (+1). Тогда жидкое состояние вещества, которое соединяет в себе и то и другое, и поэтому не является ни тем, ни другим, может быть сопоставлено с математическим символом 0, полученным как результат сложения первых двух: (-1) + (1)=0. При этом три различных фазовых состояния вещества могут быть изображены на числовой оси тремя точками, принадлежащими соответственным числовым значениям (см. рис. 6).
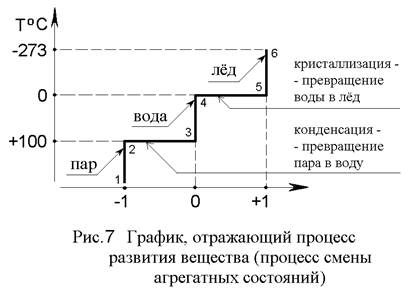
Рассмотрим в качестве конкретного примера процесс превращения пара в воду, а затем воды в лёд, представленный в виде графика на рис.7. График построен в системе координат, на вертикальной оси которой мы будем откладывать температуру внутри прозрачного сосуда с испытываемым веществом, а на горизонтальной оси условно отметим точками (-1), 0, (+1) три различных агрегатных состояния, в которых может находиться вещество. Обычно системы координат имеют точку 0 на пересечении координатных осей, параметры которых в направлении стрелок увеличиваются, но принятое нами расположении точек на осях графика делает его более наглядным, хотя при этом мы сознательно не пересекаем координатные оси друг с другом.
График превращений вещества на рис.7 показывает, что данное вещество (Н2О), охлаждаясь до температуры +100°С, устойчиво сохраняет качественное состояние в виде пара. На графике этому состоянию соответствует вертикальный отрезок 1-2. При температуре +100°С начинается и заканчивается процесс конденсации, то есть процесс превращения пара в воду, происходящий при постоянной температуре вещества (горизонтальный отрезок 2-3). Далее вода охлаждается от +100°С до 0°С, оставаясь при этом водой (отрезок 3-4). При 0°С начинается и заканчивается процесс кристаллизации льда, то есть процесс превращения воды в лёд, тоже происходящий при постоянной температуре вещества (отрезок 4-5). В дальнейшем происходит охлаждение льда до абсолютного нуля «-273°С» (отрезок 5-6). Значения температур, при которых происходит кристаллизация и конденсация вещества, в физике называются критическими точками, а в философии - точками границы меры. Теперь, давайте посмотрим, что интересного можно отметить в этом графике, представляющем собой ступенчатую линию.
Во-первых, с точки зрения философии вертикальная ось температур показывает постепенные (количественные) изменения вещества, а горизонтальная ось агрегатных состояний - скачкообразные (качественные). При этом получается, что если количественному изменению объекта (отрезок 3-4) между критическими точками на оси температур соответствует постоянное качественное состояние (облик) объекта (точка 0), то изменению качественного состояния объекта (линия 2-3) тоже соответствует постоянное значение количественного параметра (+100°С). Это показывает, что деление изменений на качественные (скачкообразные) и количественные (плавные) является чисто условным и что они происходят одинаково относительно друг друга.
Во-вторых, пользуясь терминами философии, можно сказать, что ось температур представляет собой узловую линию мер с мерами: пар, вода, лёд, и границами мер в точках +100°С и 0°С (критические точки). Ниже критической точки на графике вещество находится в одном качественном состоянии, а выше - в другом. Если мысленно равномерно двигаться по шкале температуры, то при прохождении критической точки агрегатное состояние вещества действительно изменяется скачкообразно, перескакивая с отрезка 1-2 на отрезок 3-4. В действительности же, такого мгновенного скачка не происходит. Наоборот, на критической точке происходит остановка в изменении температуры до тех пор, пока всё вещество не превратится в новое агрегатное состояние, то есть до тех пор, пока вещество не пройдёт отрезок 2-3 или 4-5. И если бы внешний наблюдатель не знал заранее форму графика и не видел вещество через прозрачные стенки испытательного сосуда, а судил бы о его состоянии только по показаниям термометра, то наблюдатель, скорее всего, сделал бы из показаний термометра выводы, совершенно противоположные действительности. Он полагал бы, что если показания термометра изменяются, то и само вещество тоже изменяется, а если показания термометра останавливаются (при +100°С и при 0°С), то и вещество перестаёт изменяться, хотя фактически именно в этих критических точках происходит превращение пара в воду, а воды в лёд.
Отсюда можно сделать очень важный вывод, что внешний наблюдатель не может заметить процесс превращения объекта из одного качественного состояния в другое, так как изменение объекта при этом не регистрируется измерительным прибором. Объект в момент превращения не воздействует или не изменяет своего воздействия на внешнюю среду. Именно этот пробел в информации и создает впечатление скачкообразного изменения объекта по отношению к внешнему наблюдателю. Фактически же, в этом «зазоре» между двумя качественными состояниями вещества на участках 2-3 и 4-5 происходит его внутренняя перестройка - конденсация и кристаллизация. Процессы перестройки происходят практически одинаково. В обоих случаях во всём объёме вещества возникают мельчайшие частицы - зародыши следующего агрегатного состояния. Затем эти зародыши растут, сливаются вместе и занимают весь объём вещества, которое после этого снова начинает проявлять себя, так как термометр начинает показывать внешнему наблюдателю изменение температуры. Таким образом, в критических точках оси температур, то есть в «зазоре» между двумя внешними проявлениями объекта (двумя качественными состояниями вещества), происходит незаметный для внешнего наблюдателя процесс его внутренней перестройки, заключающийся в развитии внутреннего зародыша нового облика объекта. Поэтому сама критическая точка не даёт определенного ответа о том, в каком именно агрегатном состоянии находится вещество в данный момент.
 Если же убрать из графика на pис.7 зоны неопределённости, а именно: отрезки 2-3, 4-5 и критические точки 0°С и +100°С, то мы получим график, изображенный на рис.8. Образно говоря, этот график показывает три агрегатных состояния вещества, как три скачкообразных следа взаимодействия вещества с внешней средой (с миром внешнего наблюдателя), разделенных процессами внутренних перестроек. Получается, что с точки зрения внешнего наблюдателя процесс развития вещества, действительно, можно считать скачкообразным.
Если же убрать из графика на pис.7 зоны неопределённости, а именно: отрезки 2-3, 4-5 и критические точки 0°С и +100°С, то мы получим график, изображенный на рис.8. Образно говоря, этот график показывает три агрегатных состояния вещества, как три скачкообразных следа взаимодействия вещества с внешней средой (с миром внешнего наблюдателя), разделенных процессами внутренних перестроек. Получается, что с точки зрения внешнего наблюдателя процесс развития вещества, действительно, можно считать скачкообразным.
Для внесения определенности в скрытые процессы внутренней перестройки необходимо ввести ещё одну ось координат, перпендикулярную к первым двум. Так как в процессе превращения вещество существует одновременно в двух агрегатных состояниях, то на третьей оси координат мы будем откладывать отношение количества нового агрегатного состояния вещества к общему количеству вещества внутри сосуда при проведении измерений. Тогда число 0 (0%) будет соответствовать началу зарождения нового агрегатного состояния вещества, а число 1 (100%) - полному переходу вещества в новое агрегатное состояние. Поскольку на рис.8 в одной плоскости изображены агрегатные состояния, охватывающие всё вещество, то мы будем считать, что им на новой координатной оси соответствует число 100%. Поэтому, с целью удобства, будем считать, что для новой оси координат в начале координат находится число 100%. Тогда возникновение зародышей нового качественного состояния и их рост будет изображаться отрезками 2″-3 и 4″-5 в горизонтальных плоскостях, проходящих через критические точки оси температур (см. рис.9).
 На рис.9 наглядно видно, что в момент прохождения остывающим веществом критической точки на оси температур, то есть в момент качественного скачка, внутри объекта (в точках 2'' и 4'') появляется зародыш нового агрегатного состояния, который развивается за счет поглощения вещества, находящегося в старом агрегатном состоянии. Чем дальше мы продвигаемся, например, от точки 4 к точке 5, тем большая часть вещества превращается в новое агрегатное состояние.
На рис.9 наглядно видно, что в момент прохождения остывающим веществом критической точки на оси температур, то есть в момент качественного скачка, внутри объекта (в точках 2'' и 4'') появляется зародыш нового агрегатного состояния, который развивается за счет поглощения вещества, находящегося в старом агрегатном состоянии. Чем дальше мы продвигаемся, например, от точки 4 к точке 5, тем большая часть вещества превращается в новое агрегатное состояние.
Если график на рис.9, отражающий внешние проявления объекта и внутренние процессы его перестройки, спроецировать на горизонтальную плоскость, то мы получим «сумму» процессов, происходящих внутри объекта при его превращениях (см. рис.10). При этом отрезки 1-2, 3-4, 5-6 превратились на рис.10 в свою проекцию на плоскость в виде точек П, В, Л, обозначающих агрегатные состояния: пар, вода, лёд. Таким образом, если внутренние процессы перестройки проецировались на ось температур в критические точки, то, в свою очередь, периоды внешнего проявления вещества проецируются в точку на плоскость внутреннего наблюдателя, то есть такого наблюдателя, который мог бы находиться внутри испытательного сосуда с ве  ществом и наблюдать рост зародышей.
ществом и наблюдать рост зародышей.
Образно говоря, график на рис.10 показывает два процесса внутренней перестройки вещества, как два следа взаимодействия вещества с миром внутреннего наблюдателя, находящегося внутри сосуда.
Тогда вся «жизнь» или всё развитие вещества, как объекта природы, может быть представлено в виде последовательного чередования периодов его внешнего проявления и внутренних перестроек: пар - (конденсация) – вода - (кристаллизация) - лёд. Исходя из этого, уже можно сказать, что, фактически, на рис.9 мы построили график превращения вещества не в осях, отражающих, как это было принято ранее, количественные и качественные изменения объекта, а в осях, отражающих взаимодействие объекта с внешним и внутренним наблюдателем или с внешней и внутренней средой. На этом мы можем пока закончить анализ процесса фазовых превращений вещества. Этот процесс общеизвестен и нам потребовалось только лишь представить его в виде наглядного графика, чтобы подчеркнуть интересующие нас моменты.
Далее мы убедимся, что полученный график отражает истинную закономерность развития, поскольку он точно описывает процессы развития и тех объектов природы, которые Ф. Энгельс брал в качестве доказательства проявления спиралевидного закона «Отрицания отрицания» в Природе.
 2020-04-20
2020-04-20 154
154








