Під дегідруванням розуміють хімічні процеси, пов'язані із відщепленням атомів водню від органічної сполуки, зокрема від спиртів [1]:
RCH2OH à RCHO + H2; (1.12)2CHOH à R2CO + H2. (1.13)
Наведені вище перетворення можна проводити за допомогою реакцій окиснення:
RR’CHOH + 0,5 О2 à RR’CO + H2О. (1.14)
У зв'язку із цим широке поширення одержали процеси окисного дегідрування, коли відщеплення водню здійснюється у присутності молекулярного кисню й кінцеві речовини утворюються як наслідок розвитку процесів окиснення, так і дегідрування:
2CH3OH + 0,5 О2 à 2НCН + H2О + Н2. (1.15)
Ці реакції займають проміжне положення між окисненням і дегідруванням і іноді настільки близько примикають до окиснення, що важко стає провести точну межу між окисненням і окисним дегідруванням [1].
Механізм утворення формальдегіду засновано на паралельно-послідовних реакціях, тобто частина продуктів утворюється по первинним хімічним реакціям, а друга частина - по наступним хімічним реакціям за участю продуктів, отриманих у первинних реакціях [2].
Найбільш вірогідним механізм утворення формальдегіду це окислювально-дегідрогенізований. Механізм утворення формальдегіду протікає через адсорбцію кисню на каталізаторі із наступною десорбцією його, при хімічній реакції окиснення метанолу у формальдегід, поміжні продукти реакції - воду та діоксид вуглецю із виділенням молекулярного металу каталізатора (срібла). Молекулярний каталізатор далі знову адсорбує кисень і знову вступає у реакцію [2].
При заглибленому вивченні хімізму реакцій, протікаючих на каталізаторі по окислювально-дегідруючому механізму утворення формальдегіду із метанолу, за проведення реакції окиснення відповідальність несе кисень, адсорбований на срібло у формі Ag(O-)адс., за реакцію дегідрування - зв'язаний атомарний двозарядний Ag(O2-)адс., а слабо зв'язаний молекулярний кисень у формі Ag(O-2)адс., забезпечує реакції глибокого окиснення метанолу до СО2 і Н2О (1.5).
Швидкість процесу окислювального дегідрування метанолу у формальдегід при прийнятих виробничих температурних режимах лімітується підводом реагентів до поверхні каталізатора, що вказує на протікання процесу у зовнішньодифузійній області. Швидкість процесу описується рівнянням першого порядку по концентрації кисню. Температурний коефіцієнт швидкості реакції відповідає температурному коефіцієнту дифузії кисню [3].
Окиснення метанолу на окисних каталізаторах протікає по окислювально-відновлювальному механізму, наприклад [3]:
СН3ОН+ 2МоО3→ СН2О + Н2О + МоО5 (1.17)
2МоО3 + 0,5О2 → 2МоО 3 (1.18)
або
СН3ОН+0,5О2→ СН2О + Н2О+ 147,4кДж (1.20)
Лімітуюча стадія як основної, так і побічної реакції - взаємодія метанолу із поверхневим киснем, тобто основний хімічний акт. Утворююча вода оказує гальмуючу дію на обидві реакції. Крім того, метанол гальмує окиснення формальдегіду до окису вуглецю і води.
Окисні каталізатори менш чутливі до домішок, ніж срібляний і його аналоги. Вираз для швидкості реакції (1.4) та (1.5)-(1.7) при постій ній температурі мають вигляд [3]:
 (1.21)
(1.21)
Та  , (1.22)
, (1.22)
Де  та
та  - константи швидкості лімітуючої стадії,1, a2, a3,b1, b2, b3 - кінетичні коефіцієнти.
- константи швидкості лімітуючої стадії,1, a2, a3,b1, b2, b3 - кінетичні коефіцієнти.
Рівняння Ареніуса для 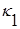 та
та  у мл/(м2с) та зерен каталізатора визначеного розміру запропоновані у формі [3]:
у мл/(м2с) та зерен каталізатора визначеного розміру запропоновані у формі [3]:
1=2,33*108exp(-18500/RT) (1.23)2=2,05 exp(-3600/RT) (1.24)
Для підтримки активності каталізатора реакцію необхідно проводити у надлишку кисню, оскільки у протилежному випадку під дією метанолу і формальдегіду каталізатор швидко руйнується. Із цього, з урахуванням меж вибуху реакційних сумішей, випливає важливіша відмінність отримання формальдегіду на окисних контактах: реакцію проводять при співвідношенні реагентів і повітря нижче нижньої межі вибуху, тобто при складі метанолу в вихідній суміші не більше 7-8%. Із порівняння рівнянь k1 та k2 бачимо, що енергії активації головної реакції більш ніж у п'ять разів перевищує той же показник побічної реакції і, тому, вихід формальдегіду повинен збільшуватись при підвищенні температури. Але було доведено, що при температурі вище 4000С каталізатор втрачає активність. Крім того, при перевищенні цієї межі, з'являються значні втрати формальдегіду через термічний розпад. З урахуванням ціх співвідношень, робоча температура процесу підтримується на рівні 350-3900С [3].
Процеси окисного дегідрування мають тепловий ефект, що залежить від частки реакцій окиснення й властно дегідрування. Оскільки окиснення завжди протікає з виділенням тепла, введенням тих або інших кількостей кисню можна широко вар’їрувати тепловий ефект сумарної реакції. Це є одним з переваг окисного дегідрування - усуваються ендотермічність процесу й необхідність у постійному підігріві реакційної системи [3].
Дуже важливою особливістю реакцій дегідрування є їхня оборотність. Очевидно, що для ендотермічних реакцій дегідрування підвищення температури буде сприяти зсуву рівноваги вправо. Температурні залежності вільної енергії дегідратації спиртів зображені на мал. 1 [1]. Близькі до нуля або негативні значення ΔG° указують на можливість практичного здійснення й на зсув рівноваги у відповідності рівнянням:
 (1.24)
(1.24)
Як видно з (мал. 1), рівновага більше зміщена вправо у вторинних спиртів (при утворенні кетонів), а менше - для первинних спиртів (особливо для метанолу), що дають при дегідруванні альдегіди.
Як видно з (мал. 2), рівновага реакції дегідрування (1.3) і окислювання (1.4) істотно зрушена у бік утворення продуктів реакції [3]. Значення констант рівноваги для реакцій окисного дегідрування значно вище, ніж для простого дегідрування. Це означає, що реакція (1.4) може розвиватися до практично повного вичерпування реагенту, узятого в недоліку, у цьому випадку кисню, невитрачений метанол може піддаватися лише простому дегідруванню або побічним перетворенням.
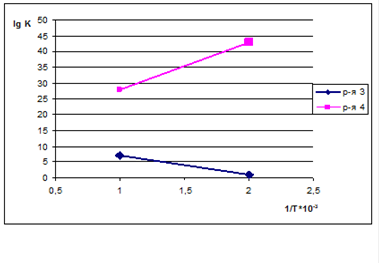
Малюнок 1 - Температурна залежність констант рівноваги реакції дегідрування (3) й окислення (4)
При дегідруванні через відщіплення водню завжди відбувається збільшення обсягу газів, і, отже, підвищенню ступеня конверсії сприяє низький тиск, тому ці процеси здійснюють при атмосферному тиску, а в деяких випадках під вакуумом, або, розбавляючи реакційну масу газом або парою, що веде до зниження парціальних тисків реагентів і росту рівноважного ступеня конверсії. Зниження парціального тиску реагентів дозволяє також знизити температуру процесу й тим самим зменшити утворення побічних продуктів.

Малюнок 2 - Температурна залежність вільної енергії дегідрування спиртів
- СН3ОН НСНО + Н2;
- С2Н5ОН СН3СНО + Н2;
- СН3СН(ОН)СН3 СН3СОСН3 + Н2
Застосування каталізаторів дозволяє досягти високої швидкості процесів при порівняно низькій температурі, коли ще не одержують значного розвитку побічні реакції.
Каталізатори реакцій дегідрування й гідрування [1] можна розділити на наступні групи:
1. метали VIII групи (Fe, Co, Ni, Pd, Pt) і I групи (Cu, Ag);
2. окисли деяких металів (MgO, Cr2O3, Fe2O3, ZnO, MoO3, WO3 і ін.);
. сульфіди кобальту,нікелю,
. молібдену й вольфраму;
. складні каталізатори, що складаються із двох і більше металів (Ni + Cu), з окислів різних металів (особливо хроміти ZnO·Cr2O3 и CuО·Cr2O3) або сульфідів (NiS∙WS3; CoS∙MoS3 и др.)
Всі вони є або провідниками струму (метали) або напівпровідниками, здатні каталізувати реакції, пов'язані з електронними переходами. Вони дезактивуються контактними отрутами, до яких належать галогени, сірчисті з'єднання, деякі метали, що спричиняється необхідність очищення сировини від цих з'єднань. Сульфіди металів, окисли молібдену й вольфраму стійкі проти дії каталітичних отрут (активність окисів навіть підвищується в присутності сірки) [1].
Селективність процесу окислювального дегідрування
Для дегідрування, завжди здійснюваного при високій температурі, щоб уникнути небажаних побічних реакцій використовують [1] менш активні каталізатори - мідь, срібло, окисли цинку, хрому, заліза й ін.
Дезактивація каталізатора у процесі роботи може бути обумовлена не тільки домішками в сировину, але й розвитком побічних реакцій, що викликають відкладення на його поверхні смолистих речовин і коксу. Регенерацію каталізатора проводять у реакторі або в спеціальному регенераторі окислюванням відкладень повітрям або водяною парою.
При температурах, характерних для виробництва, швидкість перетворення метанолу у формальдегід лімітується підведенням реагентів до поверхні зерен каталізатора, тобто процес протікає у зовнішньо-дифузійній області [3].
З переходом у зовнішньо-дифузійну область різко зростає активність і селективність каталізатора, що призводить до значного підвищення продуктивності каталізатора (на 1,5-2 порядки). При наявності внутрішньо-дифузійного гальмування в тонких порах відбувається неповне згоряння метанолу й формальдегіду до диоксиду вуглецю й води.
З підвищенням температури конверсія метанолу монотонно зростає селективність формальдегіду, що утвориться, практично постійна при збільшенні температури від 400 до 700°С, а з подальшим ростом різко знижується [3].
Селективність процесів дегідрування залежить від розвитку послідовних і паралельних реакцій, зв'язаних високою температурою проведення процесу. Наприклад, відбувається крекінг сировини, гидрогеноліз під дією водню, що утвориться, а також реакції полімеризації, циклізації й дегідроконденсації, ведучі, в остаточному підсумку, до виділення смолистих речовин і коксу, дезактивуючих каталізатор.
На тому самому каталізаторі селективність процесу залежить від ряду факторів, у тому числі від відносної реакційної здатності органічних речовин або окремих функціональних груп і від їхньої здатності адсорбуватися на поверхні каталізатора. Часто обоє фактора впливають одночасно або перший з них превалює над другим [3].
Незалежно від вибору каталізатора й інших умов на селективність дегідрування сильно впливає температура. Звичайно чим нижче температура, тим селективніше можна провести процес по більше реакційно здатних групах або зупинити його на певній проміжній стадії. Навпаки, підвищення температури сприяє глибоким перетворенням. Істотно, що небажані побічні реакції гидрогеноліза, крекінгу, дегідроконденсації й інші мають більше високу енергію активації, чим дегідрування. Оскільки при зменшенні температури одночасно зменшуються швидкість процесу й продуктивність реактора, те практично в кожному випадку можна знайти область оптимальних температур, що відповідає мінімуму економічних витрат. Додаткові обмеження на вибір цього оптимуму накладає оборотність реакції дегідрування. Нарешті, за інших рівних умов оборотність залежить від часу контакту, що визначає фактичний ступінь конверсії вихідної речовини. Чим ближче вона до рівноважного, тим значніше розвиток послідовних реакцій крекінгу або конденсації, що ведуть до зниження селективності. При дегідруванні ступінь конверсії становить іноді 20-40%, а час контакту перебуває в межах від часток секунди до декількох секунд [3].
Вибір методу виробництва формаліну
При співставленні двох методів окислювального дегідрування метанолу - на металевих (срібляних) та окисних (залізомолібденових) каталізаторах можна виділити наступні переваги та недоліки:
на срібляному каталізаторі головною перевагою є висока продуктивність, низька металоємність, простота конструкції реактора і що дуже важливо для даного проекту, немає меж по потужності одиничної установки. Але є і недоліки: високий витратний коефіцієнт по сировині, домішки у продукті, витрата дорогоцінного металу;
на окисних каталізаторах перевагою є низький витратний коефіцієнт по сировині та практично чистий готовий формалін, але низька продуктивність(8-10 тис. т/р), підвищена витрата енергії та повітря, підвищена металоємність та межі по одиниці потужності установки.
Виходячи із цього у даному проекті розробляється схема отримання формальдегіду на срібному каталізаторі [3].
ТЕХНОЛОГІЧНА ЧАСТИНА
 2020-04-20
2020-04-20 142
142