Предельные углеводороды
Карбоновые кислоты
СН4
метан
Н – СООН
муравьиная, метановая
С2Н6
этан
СН3 – СООН
уксусная, этановая
С3Н8
пропан
С2Н5 – СООН
пропионовая, пропановая
С4Н10
бутан
С3Н7 – СООН
масляная, бутановая
С5Н12
пентан
С4Н9 – СООН
валериановая, пентановая
С6Н14
гексан
С5Н11 – СООН
капроновая, гексановая
Физические свойства.
Молекулы карбоновых кислот подобно спиртам могут образовывать водородные связи друг с другом и с молекулами воды. С возрастанием молекулярной массы растворимость карбоновых кислот в воде падает.
Высшие кислоты в воде практически нерастворимы.
Кислоты с число атомов углерода в молекуле от 1 до 9 при комнатной температуре-жидкости с неприятным, раздражающим запахом. Высшие карбоновые кислоты запаха не имеют.
Химические свойства.
- Кислотные свойства:
а) диссоциация

б)с металлами
2СН3СООН + Mg → (CH3COO)2Mg + H2
в) с основными оксидами
2СН3СООН + MgO → (CH3COO)2Mg + H2O
г) с основаниями
СН3СООН + NaOH → CH3COONa + H2O
д) с солями
2СН3СООН + CaCO3 → (CH3COO)2Ca + H2O + CO2
- Реакция этерификации.

- Реакции по углеводородному радикалу.
СН3 – СООН + Cl2 → Cl – CH2 – COOH + HCl
хлоруксусная кислота
Получение и применение уксусной кислоты.
- Окисление этанола.
С2Н5ОН + О2 → СН3СООН + H2O
- Окисление ацеталъдегида.

3. Окисление бутана.
2С4Н10 + 5О2 → 4СН3СООН + 2H2O
Основная часть получаемой уксусной кислоты используется для производства искусственных волокон и пластмасс на основе целлюлозы, для производства красителей, ядохимикатов.
ВЫСШИЕ КАРБОНОВЫЕ КИСЛОТЫ
С15Н31СООН – пальмитиновая кислота
С17Н35СООН – стеариновая кислота
С17Н33СООН – олеиновая кислота
С17Н31СООН – линолевая кислота
Высшие карбоновые кислоты вступают в те же реакции, чтои другие кислоты.
Соли высших карбоновых кислот называются мылами.
Мыла.
Мыла - соли высших карбоновых кислот.
1. Моющие мыла.
С17Н35СООNa – твердое мыло
С17Н35СООK –жидкое мыло
Мыла проявляют свойства солей, то есть реагируют с кислотами, щелочами и растворами других солей, а также подвергаются гидролизу.
2C17H35COONa + BaCl2 → (C17H35COO)2Ba↓ + 2NaCl
2C17H35COO- + 2Na+ + Ba2+ + 2Cl- → (C17H35COO)2Ba↓ + 2Na+ + 2Cl-
2C17H35COO- + Ba2+ → (C17H35COO)2Ba↓
C17H35COONa + H2O → C17H35COOH↓ + NaOH
C17H35COO- + Na+ + H2O → C17H35COOH↓ + Na+ + OH-
C17H35COO- + H2O → C17H35COOH↓ + OH-
2. Немоющие мыла.
(C17H35COO)2Сa, (C17H35COO)3Al
Немоющие мылаиспользуются для изготовления консистентных смазок (солидол) и для получения напалма.
СЛОЖНЫЕ ЭФИРЫ.
Производные карбоновых кислот, в которых атомы водорода карбоксильной группы замещены на углеводородные радикалы, называют сложными эфирами.
Общая формула сложных эфиров 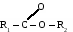
Физические свойства.
Сложные эфиры низших карбоновых кислот представляют собой летучие жидкости, многие из которых обладают приятным фруктовым или цветочным запахом. Они практически нерастворимы в воде.
 2020-05-12
2020-05-12 327
327








