Сыктывкар 2016
СОДЕРЖАНИЕ
Введение…………………………………………………………………………………………3
I Понятие о комплексном соединении. Типы комплексов…………………………………4
II Номенклатура комплексных соединений………………………………………………….9
III Хелатный эффект…………………………………………………………………………..12
IV Влияние природы центрального атома на процесс комплексообразования и устойчивость комплексных соединений……………………………………………………...16
V Влияние природы донорного атома…………………………………………………… 21
VI Влияние природы функциональной группы реагента………………………………. 22
VI Влияние размера цикла………………………………………………………………….25
VII Влияние заместителей в молекуле реагента на устойчивость комплексов………….26
I Получение растворов окрашенных соединений и использование их в количественном фотометрическом анализе……………………………………………………………………..28
II Этапы исследования фотометрических реакций с органическими реагентами………29
II.1 Исследование органического реагента………………………………………………… 29
II.2 Исследование раствора определяемого элемента………………………………………29
II.3 Исследование водорастворимых комплексных соединений…………………………. 30
II.4 Экстракция комплексного соединения органическими растворителями. Изучение экстракционно-фотометрической системы………………………………………………….. 33
Экспериментальная часть. Изучение реакции комплексообразования иона металла с органическим реагентом ксиленоловым оранжевым……………………………………….. 34
Лабораторная работа №1 Определение оптимальных условий реакции комплексообразования фотометрическим методом. Растворы окрашенных соединений и их основные характеристики…………………………………………………………………. 35
Исследование влияния компонентов ацетатной буферной системы на спектры поглощения раствора ксиленолового оранжевого в присутствии ионов металла……… 39
Лабораторная работа №2 Установление состава комплексного соединения. Метод непрерывных изменений (метод изомолярных серий)……………………………………. 40
2.1.1 Графический метод определения состава комплексного соединения…………………………………………………………………………………….. 42
2.1.2 Математический метод определения состава комплексного соединения………………………………………………………………………………………42
2.2 Метод молярных отношений (метод «насыщения»)………………………………….. 44
2.3 Метод пересечения кривых……………………………………………………………… 46
Лабораторная работа № 3. Оценка кажущихся коэффициентов погашения, условных констант устойчивости комплексных соединений ксиленолового оранжевого с ионами Pb+2, Zn+2, Cо+2, Cо+3, Сu+2, Cd+2……………………………………………………………… 46
3.1 Метод изомолярных серий…………………………………………………………………47
3.2 Метод молярных отношений (метод «насыщения»)……………………………………..47
Примерные варианты контрольных работ………………………………………………….. 52
Примеры интерактивной формы проведения занятий……………………………………... 53
Литература ……………………………………………………………………………………...54
ВЕДЕНИЕ
Способность к координации проявляют почти все элементы таблицы Д.И.Менделеева. У некоторых, главным образом, переходных металлов, они выражены настолько сильно, что химические свойства этих соединений вообще невозможно понять без учета процесса комплексообразования. Исследование физиологической активности веществ, полученных в рамках современных нанотехнологий из минерального сырья, экологических особенностей объектов биосферы, решение экологических проблем считается возможным лишь с привлечением химии комплексных соединений. Сегодня практически не существует отрасли, где не были бы в той или иной степени востребованы координационные соединения. В то же время большинство многочисленных координационных соединений, возможность синтеза которых можно предсказать теоретически, представляют интерес только с научной точки зрения. В аналитической химии находят применение лишь некоторые типы комплексных соединений, обладающих особыми свойствами и удовлетворяющих определенным требованиям, а это значит, что значение этого раздела химии в образовании студента-химика трудно переоценить.
При изучении дисциплины "Химия комплексных соединений" необходимо уметь определять понятие "комплексное", или "координационное" соединение, координационное число комплексообразователя и дентатность лигандов, различать понятия "комплексный ион" и "комплексное" или "координационное соединение". Немаловажное значение имеет также отнесение того или иного комплексного соединения к определенному типу комплексов.
Необходимо также знать, что в литературе употребляются различные способы названий комплексных соединений: как практические, тривиальные, так и названия, составленные согласно рациональной номенклатуре, основанной на рекомендациях Международного союза по чистой и прикладной химии ИЮПАК, и являющейся в настоящее время общепринятой. Основной принцип этой номенклатуры состоит в том, чтобы отразить в названии как можно полнее состав и строение комплексного соединения.
В практикуме по химии комплексных соединений важная роль отводится определению условий реакции комплексообразования, обеспечивающей максимальный выход единой оптически активной устойчивой формы комплексного соединения, определения молярного отношения комплексообразователь: полидентатный лиганд, константы устойчивости комплексного соединения, а также возможности его аналитического использования.
Для того, чтобы помочь студенту успешно освоить этот достаточно сложный курс химии комплексных соединений, предназначены настоящие методические указания и рекомендации.
1 Понятие о комплексном соединении
1.1 Типы комплексов
Дать достаточно удовлетворительное, однозначное определение понятия "комплексное соединение" не представляется возможным, поскольку нет возможности провести четкую границу между так называемыми простыми и комплексными соединениями. Однако в первом приближении определение понятия комплексного соединения следующее:
комплексное соединение - это соединение, которое образуется при взаимодействии акцепторов и доноров электронов. Понятно, что такое определение охватывает большой круг соединений, в частности, солей аммония.
В химии комплексных соединений частицу, которая является акцептором электронной пары, называют комплексообразователем (кислота Льюиса). Такой частицей может быть ион (атом) металла, который, кроме того, называют центральным атомом или центральным ионом. В качестве донора электронной пары могут выступать анионы или нейтральные молекулы как органические, так и неорганические по своей природе. Их называют лигандами (основание Льюиса). Если частица-лиганд содержит только один донорный атом, то образуются «обычные» комплексы – Cu(NH3)4SO4 и др.. Если взаимодействующий с акцептором электронной пары реагент (лиганд), содержит два или более атомов с донорными свойствами - лигандных атомов, то образующееся соединение содержит один или несколько циклов. Соединение такого типа называют "хелатом", а лиганд - хелатообразующим реагентом, или хелатным лигандом. Не всякий лиганд, содержаний несколько донорных атомов, может выступать как хелатообразующий. Для этого необходимо такое расположение донорных атомов, чтобы они могли координироваться одним и тем же комплексообразователем одновременно. Например, гидразин Н2N-NН2 (два донорных атома) координируется только одним атомом азота, в то время как этилендиамин Н2N-CН2-CН2- NН2 (en) одновременно координируется двумя атомами азота. В гидразине расстояние между двумя атомами азота слишком мало для того, чтобы осуществилась координация обоих атомов азота без искажения связи между ними, в то время как в этилендиамине это расстояние достаточно велико, отсутствуют стерические факторы. Следовательно возможность координации требует вполне определенного размера хелатного цикла.
Таким образом, несмотря на то, что хелатный лиганд может иметь несколько донорных атомов, из-за несоответствия между координационными или структурными требованиями иона-комплексообразователя и лиганда могут координироваться не все донорные атомы или даже только один. В молекуле полифенола

одним и тем же центральным атомом одновременно могут координироваться только две ОН -группы, находящиеся в орто-положении.
Число донорных атомов хелатообразующего реагента, одновременно координируемых одним и тем же центральным атомом (ионом), определяет "дентатность" данного лиганда.
Монодентатные лиганды: H2O, NH3, OH-, Hal-, гидразин.
Этилендиамин, полифенол - бидентантные хелатообразующие диганды. Дентатность лигандов и число связей лигандных донорных атомов с ионом-комплексообразователем определяют число возможных хелатных циклов.
Число связей, образуемых комплексообразователем со всеми донорными атомами, принадлежащими одному или нескольким лигандам, определяет координационное число комплексообразователя (центрального иона).
Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения, которую заключают в квадратные скобки и называют комплексным ионом, заряд которого равен алгебраической сумме зарядов иона - комплексообразователя и лигандов. Внешнесферный ион компенсирует заряд комплексного иона.
1.2 Комплексные ионы
Образование комплекса не всегда сопровождается насыщением заряда центрального иона. При присоединении нейтральных лигандов положительно заряженным ионом комплексообразователя образующийся комплекс имеет заряд, равный заряду исходного катиона; такая реакция приводит к образованию комплексного катиона. При присоединении отрицательно заряженных лигандов могут образоваться отрицательно заряженные комплексные ионы – анионы.
Частным случаем заряда комплексного иона может быть нуль.
Если в составе органического хелатообразующего лиганда содержатся кислотные или основные, но при этом не координируемые металлом группы, например, - SO32- , - SO3H, то образуются комплексные соединения, которые называют "анионные хелаты".
1. 3 Внутрикомплексные соединения
Под внутрикомплексными соединениями подразумевают солеобразные соединения, в которых комплексообразователь соединен с каким-либо реагентом (лигандом) с помощью сил как главной, так и побочной валентности. Например, при взаимодействии иона меди(II) с аминоуксусной кислотой образуется незаряженный хелат - гликолят меди:
 ,
,
при образовании которого положительный заряд иона меди нейтрализуется ацетатными группами хелатообразующего реагента, в то время как незаряженные аминогруппы связываются координационно.
Все бидентатные хелатные лиганды с одной заряженной и одной незаряженной донорными группами образуют внутрикомплексные соединения в том случае, если координационное число иона-комплексообразователя равно его удвоенному положительному заряду. Если же величина положительного заряда иона-комплексообразователя меньше, то свободные координационные места занимают нейтральные лиганды – молекулы растворителя (Н2О), например, в молекуле комплексного соединения [Mg Ox2(H2O)2], где в качестве лиганда выступает бидентатный реагент 8- оксихинолин (структурная химическая формула и название хелата представлены ниже):

бис-(8- оксихинолинато)диаквомагний [Mg Ox2(H2O)2]
Отличительными свойствами внутрикомплексных соединений является то, что они, как правило, нерастворимы в воде и водных растворах и хорошо растворимы в органических растворителях, не смешивающихся с водой, что востребовано в аналитической практике.
Однако, если при образовании хелата положительный заряд хелатного катиона нейтрализуется отрицательно заряженными заместителями в молекуле лиганда, не связанными с ионом-комплексообразователем, например, сульфогруппами, то такое соединение нельзя считать внутрикомплексным, хотя в результате образуется нейтральный хелат. Нейтральные хелаты такого типа отличаются от истинных внутрикомплексных соединений гораздо лучшей растворимостью в воде и водных растворах, что также востребовано и используется в аналитических исследованиях многокомпонентных систем.
Некоторые хелатные лиганды дают два типа внутрикомплексных соединений. Например, дитизон (Dz)

реагирует в нейтральных и слабокислых растворах как бидентатный хелатный лиганд с образованием "первичных дитизонатов", таких, как Pb(HDz)2. Катионы некоторых металлов (Ag+, Pd2+) в сильнощелочных растворах взаимодействуют с отщеплением протона от атома азота с образованием "вторичных" дитизонатов (Ag2Dz, PdDz) которые, вероятно, представляют собой полиядерные комплексы с дитизоном в качестве двухосновного тридентатного лиганда.
1.4 Эфирные хелаты
Высокозарядные катионы небольшого размера, образуемые элементами ванадием, титаном, молибденом, вольфрамом и т.п., находятся в водных растворах не в виде гидратированных катионов, а образуют оксо- или гидроксокомплексы, т.е. присутствуют в растворах в виде оксоанионов или оксокислот. В процессе комплексообразования оксо- и гидроксолиганды вытесняются из координационной сферы центрального иона лишь немногими бескислородными лигандами (F-, например).
Образование хелатов высокозарядными катионами элементов небольшого размера можно представить как образование эфира недиссоциированной гидроксокислоты со спиртовыми или фенольными OH- - группами хелатообразующего лиганда. Следующая ступень реакции комплексообразования - взаимодействие другого донорного атома хелатного лиганда с вакантным местом в координационной сфере центрального иона. Типичный пример образования эфирных хелатов:

Образованный таким образом хелат можно рассматривать как циклический эфир ортоборной кислоты. Что касается характера связей, то эти соединения не отличаются от бициклических эфирных анионов. Эфирные хелаты образуются и с другими слабыми или относительно сильными кислотами. Хелаты, образованные оксогидроксо-ванадием(V), диоксомолибденом(VI), диокcовольфрамом(VI) и диоксоураном (VI), можно также рассматривать как хелаты, образованные соответствующими окcокислотами:


В щелочных растворах хелатные лиганда такого типа разрушаются с образованием оксоанионов.
Различие эфирных и обычных хелатов состоит в том, что эффективная устойчивость обычных хелатов обуславливается конкуренцией между ионом металла и протоном за анион хелатного диганда и поэтому возрастает с повышением рН раствора. В случае эфирных хелатов эта величина повышается с уменьшением рН, т.к. она определяется конкуренцией между гидроксо- и оксоанионами хелатного лиганда за ион металла. Таким образом, механизм реакций образования, близость химических свойств со свойствами эфира и то, что эти хелаты образуются предпочтительно в кислых растворах, позволяет выделить их в отдельную группу эфирных хелатов.
Необычное поведение эфирных хелатов в растворах представляет большую ценность с аналитической точки зрения: в кислых растворах образованию эфирных хелатов не будет мешать образование хелатов другими металлами и, наоборот, элементы, для которых характерно образование эфирных хелатов, не будут мешать образованию обычных хелатов в щелочных растворах. Это может быть положено в основу разработки методов аналитического разделения катионов.
1.5 Ионные ассоциаты (ионные пары)
Соединения такого типа невозможно однозначно отнести к комплексным или координационным соединениям. Например, галогениды ртути (II) слабо диссоциируют в водных растворах и формально их можно отнести к ионным парам - галоген соединён с атомом ртути (II) ковалентной связью. В то же время галогениды ртути легко присоединяют дополнительные ионы галогенов, образуя тем самым галогенортутные комплексы.
Не диссоциируемые нейтральные галогениды и комплексные соединения различаются только механизмом реакцией образования, но отнюдь не характером связи металл - галоген.
Галогенортутные анионы, в свою очередь, способны образовывать ионные пары с замещенными аммониевыми, оксониевыми или хелатными катионами. Продукты образования и называют комплексными, или хелатными ионными ассоциатами. Эти соединения, четко отличаются от собственно координационных соединений (внутрисферных комплексов) тем, что лиганды, образующие ионные пары, не связаны непосредственно с центральным атомом комплексной частицы.
При изображении образования ионной пары в виде формулы оба партнера принято разделять точкой с запятой, а весь ассоциат заключают в фигурные скобки:
{(RH)+ ; [MLn]- }
Комплексные ионные ассоциаты хорошо растворимы в органических растворителях. Роль катиона ионной пары играют протонированные молекулы полярных органических растворителей, так называемые "ониевые катионы".
При экстракции металлов из водных растворов могут извлекаться одновременно соединения двух типов: HgX2 и {(RH)+;[HgX3]-}.
Некоторые хелатные или комплексные ионы, которые сами по себе не экстрагируются, можно извлечь, используя образование ионных пар с катионами или анионами большого размера. Так, при добавлении к водным растворам роданида кобальта (II), ацетона или других кетонов, спиртов или альдегидов, растворы приобретают интенсивное голубое окрашивание. Появление окрашивания объясняется образованием ионных пар анионом тетрароданидокобальта (II) с "ониевым" катионом:
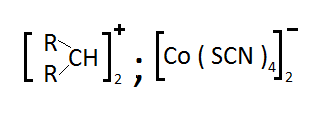
При этом оксонивый катион может быть заменен на замещенный аммониевый, фосфониевый, арсониевый, стибониевый катион. Псевдогалогенидные комплексы многих других металлов (Fe3+,Cu2+,Pd2+,UО22+,Cr3+,Rh3+,Ru3+) также экстрагируются в виде ионных пар этого типа. С другой стороны, простые неорганические анионы (Cl-,Br-,I-,ClO4-,MnO4-,ReO4-,ClO3-,Cr2O72-) экстрагируются органическими растворителями в виде ионных ассоциатов с катионами тетрафениларсония, тетрофенилфосфония, трифенилсульфония, трифенилолова, трифенилсвинца.
Вместо замещенных "ониевых" или металлорганических катионов могут использоваться хелатные катионы, например, катион трис-(о-фенантролин) железа (II) [Fe(phen)3]2+ . Эта реакция может быть использована для определения как ионов железа, так и анионов в виде ионных ассоциатов при решении аналитических задач.
Хелатные анионы могут образовывать экстрагируемые ионные пары с катионами большого размера. Практическую значимость имеют такие ионные пары, в состав которых входят окрашенные катионы метиленового голубого, родамина Б и т.п., при этом бесцветные хелаты переводятся в соединения, которые можно использовать в фотометрическом анализе.
Хелаты, содержащие сульфогруппу (одну или несколько) и поэтому хорошо растворимые в водных растворах, например, образованные нитрозо-R-солью:

или ферроном:

также образуют экстрагируемые ионные пары с катионами большого размера, что используется для отделения исследуемых ионов от других, а также от избытка свободного реагента.
Образование ионных пар оказывает существенное влияние на кинетику химических реакций с участием комплексных соединений. Например, скорость обменной реакции
[Mn+ (NH3)Xm-](n-m)+ +H2O ↔ [Mn+ (NH3)(H2O)]n++Xm-,
где (M=Co; Cr; X= Cl-,SCN-,SO42-),
в присутствии двухзарядного аниона SO42- возрастает примерно в два раза быстрее, чем в присутствии однозарядных анионов (NO3-, SCN-). Диссоциация [Fe(phen)3]3+ (замена молекулы фенантролина на молекулу Н20), наоборот, в присутствии анионов замедляется, например, с 6∙10-3 до 1,5∙10-3 мин-I в растворе с молярной концентрацией серной кислоты с(H2SO4) = 1 моль/дм3 и до 0,4∙10-3 мин-I в растворе с молярной концентрацией азотной кислоты с(HNO3) = 1 моль/дм3 (25°С), в то время как скорость диссоциации [Fe(phen)3]2+ в растворах с равными концентрациями анионов замедляется всего лишь примерно на 10%. Аналогичные зависимости наблюдаются и для хелата никеля.
Рассмотренные особенности свойств ионных ассоциатов можно объяснить электростатическими эффектами. Влияние ионного ассоциата на скорость обмена лигандами связано со степенью ассоциации по Бьерруму, которая, как и ассоциация, возрастает с увеличением заряда аниона, образующего соответствующую ионную пару. При этом предполагается, что поле ассоциированных анионов способствует повышению электронной плотности связи металл-лиганд в комплексах. В результате скорость обмена незаряженных лигандов (phen) понижается. В случае отрицательных лигандов сила отталкивания между лигандами комплекса и ионной пары приводит к увеличению скорости обмена. Для хелатного катиона, например, [Fe(phen)3]2+ , вода из гидратной оболочки может вытесняться ассоциированным ионом, что приводит к снижению скорости гидратации исходного катиона хелата.
II Номенклатура комплексных соединений
Рациональная номенклатура координационных соединений придерживается единого принципа: названия этих соединений должны отражать их состав.
II. I Номенклатура моноядерных комплексных ионов
Если координационное соединение построено ионно, то называют комплексное соединение по типу названия солей: в первую очередь называют анион, затем катион (или катионы) в родительном падеже вне зависимости от того, комплексными они являются или образуют внешнюю сферу:
[Cu(NН3)4]2+ CI2
При названии комплексного иона независимо от того, катион он или нейтральная частица, лиганды перечисляют, начиная с отрицательно заряженных ионов в алфавитном порядке, затем называют нейтральные, далее - центральный атом, указывая (римской цифрой в скобках) его состояние окисления. Если комплексный ион - анион, к названию центрального атома прибавляют суффикс "ат" и вслед за этим указывают его состояние окисления.
Названия отрицательных (анионных) лигандов образуются добавлением суффикса "о" к его собственному названию: CN— -циано-(цианато-), Cl— -хлоро-, SO42— -сульфато-, SCN—-тиоцианато-, OH— -гидроксо-, O2— -оксо-, NH2-амидо-, NH— -имидо-, С2О42- - оксалато и т.п. Число лигандов каждого вида обозначают, используя греческие приставки ди-, три-, тетра-, пента-, гекса- и т.д. Название приведенного в качестве примера комплексного соединения: хлорид тетрамминмеди (II).
Некоторые специфические правила: поскольку SCN- -анион в качестве лиганда может координироваться комплексообразователем в зависимости от его природы как по атому серы, так и по атому азота, то, если известно различие в координации, его отражают в названии: тиоцинато-S, тиоцинато-N; соответственно, в случае лиганда – аниона NO2-: если координация по атому азота, лиганд называют - нитро-, по атому кислорода – нитрито-.
Названия нейтральных лигандов несистематизированы. Для менее обычных лигандов, в особенности, органического происхождения, используют их собственные названия.
Наиболее важные: H2O -акво, NH3 - аммин, СО -карбонил, NO-нитрозил. Суффикс "о" в название не вводится. Примеры:
[Cu(NH3)4]Cl2- хлорид тетрамминмеди (II)
[Cr(H2O)4 Cl2]Cl - хлорид дихлоротетраквохрома (III)
[(CH3)4N]2 [Co(SCN)4] - тетраметиламмонийтетрацианатокобальтат (III)
K3[Al(C2O4)3]- триоксалатоалюминат (III) калия
K[PtCl3(NH3)]- трихлороамминплатинат (II) калия
K3[Co(CN)5NO] - пентацианонитрозилкобальтат (III) калия.
Если лиганды сами по себе представляют сложные соединения и соответственно этому имеют сложные названия, или уже содержат числительные в собственном названии, или цифровые приставки, то их названия заключаются в круглые скобки, а число лигандов указывают приставками бис- (2), трис- (З), тетракис- (4), пентакис- (5) и т.д.
[Co en3]Cl3, где H2N-CH2-CH2-NH2 (en):
трис (этилендиамин)кобальта (III) хлорид
[Fe(phen)3]Cl2:
трис (фенантролин) железа (II) хлорид.
В составе полиядерных комплексов монодентатные лиганды могут быть одновременно координированы двумя или более ионами металлов, образуя так называемые "мостиковые группы":
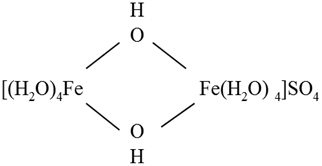
Лигандам, связывающим одновременно два центральных атома, предшествует в названии греческая буква M «мю», которая повторяется перед каждым различным видом мостиковой группы:
сульфат октааково - M -, M- дигидроксодижелеза (II).
(При написании названия комплексного соединения -M- выделяется дефисом)

нитрат октаммин - M -,- M - диамидодикобальта (III).
В комплексных ионах лиганды могут занимать различные места вокруг центрального атома, образуя, таким образом, пространственные изомеры. Этот тип изомерии называют пространственной (геометрической) цис - транс - изомерией. Цис - транс - изомерия характерна для плоских квадратных и октаэдрических комплексов. В тетраэдрических комплексах все координационные места смежные.
Пространственные изомеры называют, используя приставку цис - для обозначения смежных положений лигандов и транс - для обозначения противоположных.
Иногда использует систему чисел:
а) плоские квадратные комплексы
 1-3- и 2-4- лиганды, находящиеся в транс- положении:
1-3- и 2-4- лиганды, находящиеся в транс- положении:

Транс - хлоронитродиамминплатина (II)
1-хлоро - 3 - нитродиамминплатина (II) 
1-хлоро- 3-нитро-бромоамминплатина (II) – ион.
При использовании системы цифр для названия пространственных изомеров достаточно указать лишь две цифры, обозначающие транс-положение заместителей. Это обусловлено тем, что в плоских квадратных комплексах два других лиганда могут находиться только в транс- положении относительно друг друга.
б) Октаедрические комплексы: в транс - положении относительно друг друга находятся лиганды, занимающие положения 1-6; 2-4; 3-5.

Py: C6H5-N
Транс-хлоронитро-транс-бромойодоамминпиридинплатина (IV)
1-хлоро-2-бромо-4-йодо-6-нитроамминпиридинплатина (IV)
в) Октаедрические комплексы: комплексный ион содержит один симметричный циклический заместитель. Например,
[CoEn(NH3)2(H2O)NO2]Br2.
В первую очередь называют циклообразующий заместитель, затем два противоположных ему лиганда и лишь потом - лиганды, расположенные по вертикальной координате.
Название предложенного в качестве примера соединения можно построить по-разному в зависимости от того, как расположены лиганды относительно друг друга. Возможны следующие варианты конфигурации:
бромид этилендиаминамминамминаквонитрокобальта (III)

бромид этилендиаминнитроаквоамминамминкобальта (III)

бромид этилендиаминаквоамминнитроамминкобальта (III) 
 2020-05-11
2020-05-11 229
229








