| *N2O | NO | **N2O3 | NO2 | *N2O5 |
| Оксид азота (I), оксид диазота, «веселящий» газ | Оксид азота (II), монооксид азота | Оксид азота (III), триоксид диазота, азотистый ангидрид | Оксид азота (IV), диоксид азота, бурый газ | Оксид азота (+5), пентаоксид диазота, азотный ангидрид |
| Несолеобразующие оксиды | Солеобразующие кислотные оксиды | |||
| Бесцветный газ | Бесцветный газ | Синяя жидкость | Бурый газ | Бесцветное твердое вещество |
| Малорастворимы в воде | Хорошо растворимы в воде, образуя кислоты: | |||
| HNO2 азотистая кислота | HNO2 и HNO3 | HNO3 азотная кислота | ||
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ ОКСИДЕ АЗОТА(II)
Получение:
В промышленности
1) Прямой синтез: N2 + O2  2NO↑
2) Сжигание аммиака: 4NH3 + 5O2 2NO↑
2) Сжигание аммиака: 4NH3 + 5O2  4NO↑ + 6H2O
В лаборатории
3) Взаимодействием меди с раствором азотной кислоты:
3Cu + 8HNO3 (p-p) 4NO↑ + 6H2O
В лаборатории
3) Взаимодействием меди с раствором азотной кислоты:
3Cu + 8HNO3 (p-p)  2NO↑ + 4H2O + 3Cu(NO3)2 2NO↑ + 4H2O + 3Cu(NO3)2
|
| Физические свойства: Газ без цвета и запаха, малорастворим в воде. Ядовит: поражает дыхательные пути. В 1,035 раза тяжелее воздуха. |
| Химические свойства: Несолеобразующий оксид: с водой, щелочами и оксидами металлов не взаимодействует. Легко окисляется кислородом: 2NО + O2 → 2NO2↑ |
| Применение: Для получения азотной кислоты. |
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ ОКСИДЕ АЗОТА(IV)
Получение:
В промышленности
1) Окисление монооксида азота: 2NO + O2 → 2NO2↑
В лаборатории
2) Взаимодействием меди с концентрированной азотной кислотой:
Cu +4HNO3 (конц.)  2NO2↑ + 2H2O + Cu(NO3)2
3)Разложение нитратов: 2Cu(NO3)2 2NO2↑ + 2H2O + Cu(NO3)2
3)Разложение нитратов: 2Cu(NO3)2  2CuO + 4NO2↑+ O2↑
*4) Окислением серы или фосфора концентрированной азотной кислотой:
S + 6HNO3(конц.) 2CuO + 4NO2↑+ O2↑
*4) Окислением серы или фосфора концентрированной азотной кислотой:
S + 6HNO3(конц.)  H2SO4 + 6NO2↑+ 2H2O
Р + 5HNO3(конц.) H2SO4 + 6NO2↑+ 2H2O
Р + 5HNO3(конц.)  H3РO4 + 5NO2↑+ H2O H3РO4 + 5NO2↑+ H2O
|
| Физические свойства: Газ бурого цвета с резким запахом, хорошо растворим в воде. Очень ядовит: сильно поражает дыхательные пути. В 1,59 раза тяжелее воздуха. **При обычных условиях (t° ≈ +25°C) существует в смеси с димером: 2NO2 ⇄ N2O4. При понижении температуры увеличивается содержание N2O4 (при t° ниже –12°C присутствуют только бесцветные кристаллы N2O4), а при увеличении – NO2 (при t° выше +140°C присутствует только тёмно-бурый NO2). |
Химические свойства:
Солеобразующий кислотный оксид
1) С водой: 2NO2 + H2O → HNO3 + НNO2 образуется две кислоты
3NO2 + H2O → 2HNO3+ NO↑
4NO2 + 2H2O + O2  4HNO3(конц.)
2) Со щелочами образует два ряда солей – нитриты и нитраты:
2NO2 + 2NaOH → NaNO2+ NaNO3+ H2О
3) С основными оксидами: 2NO2 + Na2O → NaNO2+ NaNO3
**4) Очень сильный окислитель: 2С + 2NO2 4HNO3(конц.)
2) Со щелочами образует два ряда солей – нитриты и нитраты:
2NO2 + 2NaOH → NaNO2+ NaNO3+ H2О
3) С основными оксидами: 2NO2 + Na2O → NaNO2+ NaNO3
**4) Очень сильный окислитель: 2С + 2NO2  2СO2↑ + N2↑
8Р + 10NO2 2СO2↑ + N2↑
8Р + 10NO2  4Р2O5↑ + 5N2↑
**5) С озоном: 2NO2 + О3 → N2O5 + O2↑ 4Р2O5↑ + 5N2↑
**5) С озоном: 2NO2 + О3 → N2O5 + O2↑
|
| Применение: Для получения азотной кислоты и её солей нитратов. |
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ ОКСИДЕ ФОСФОРА(V)
| Р2O5 – фосфорный ангидрид, пентаоксид дифосфора |
Получение:
В промышленности
1) Прямой синтез: 4Р + 5O2  2Р2O5
В лаборатории
2) Разложением фосфорной кислоты:
2H3РO4 2Р2O5
В лаборатории
2) Разложением фосфорной кислоты:
2H3РO4  Р2O5 + 3H2O
3)Разложение фосфатов:
Cа3(РO4)2 Р2O5 + 3H2O
3)Разложение фосфатов:
Cа3(РO4)2  3CаO + Р2O5
**4) Окислением фосфора:
8Р + 10NO2 3CаO + Р2O5
**4) Окислением фосфора:
8Р + 10NO2  4Р2O5↑ + 5N2↑ 4Р2O5↑ + 5N2↑
|
| Физические свойства: Белое кристаллическое вещество, рыхлое (похожее на снег) и гигроскопичное (легко поглощает влагу), отлично растворимое в воде. Ядовито. |
Химические свойства:
Солеобразующий кислотный оксид
1) С водой:
P2O5+ H2O→ 2HРO3 (метафосфорная кислота)
P2O5+ 3H2O  2H3РO4 (ортофосфорная кислота)
2) Со щелочами:
P2O5 + 2NaOH + Н2О → 2NaН2РO4 (дигидрофосфат натрия)
P2O5 + 4NaOH → 2Na2НРO4 + H2O (гидрофосфат натрия и вода)
P2O5 + 6NaOH → 2Na3РO4 + 3H2O (фосфат натрия и вода)
3) С основными оксидами:
P2O5+ 3Na2O → 2Na3РO4 (фосфат натрия) 2H3РO4 (ортофосфорная кислота)
2) Со щелочами:
P2O5 + 2NaOH + Н2О → 2NaН2РO4 (дигидрофосфат натрия)
P2O5 + 4NaOH → 2Na2НРO4 + H2O (гидрофосфат натрия и вода)
P2O5 + 6NaOH → 2Na3РO4 + 3H2O (фосфат натрия и вода)
3) С основными оксидами:
P2O5+ 3Na2O → 2Na3РO4 (фосфат натрия)
|
| Применение: 1) Для получения фосфорных кислот и их солей (минеральные удобрения). 2) Как водоотнимающее средство и осушитель газов. |
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ ОКСИДЕ УГЛЕРОДА(II)
| СO – угарный газ, монооксид углерода |
Получение:
В промышленности
1) Прямой синтез: 2С + O2  2СО↑
2) Взаимодействие кокса с углекислым газом: С + СO2 2СО↑
2) Взаимодействие кокса с углекислым газом: С + СO2  2СО↑
3) Взаимодействие кокса с оксидами металлов: С + СuO 2СО↑
3) Взаимодействие кокса с оксидами металлов: С + СuO  Cu + CO↑
В лаборатории
4) Разложение муравьиной кислоты:
НСООН Cu + CO↑
В лаборатории
4) Разложение муравьиной кислоты:
НСООН  СО↑ + H2O СО↑ + H2O
|
| Физические свойства: Газ без цвета и запаха, плохо растворим в воде. В 1,036 раза легче воздуха. Горючий. Очень ядовит. При вдыхании угарного газа, он взаимодействует с железом, входящим в состав гемоглобина, образуя устойчивый комплекс *(пентакарбонил железа – [Fe(CO)5]). В результате чего, перенос кислорода от лёгких к тканям замедляется, что вызывает сначала кашель и одышку, затем паралич и смерть. Первая помощь: избыток чистого воздуха или кислорода, покой и сладкий горячий чай. |
Химические свойства:
Несолеобразующий оксид
1) При обычных условиях не взаимодействует с водой и щелочами.
2) С кислородом: 2СO + О2  СО2↑
3) С оксидами металлов: СO + СuO СО2↑
3) С оксидами металлов: СO + СuO  Cu + CO2↑
*4) С хлором: СО + Cl2 Cu + CO2↑
*4) С хлором: СО + Cl2  COCl2↑ (фосген – сильный яд!)
*5) Со щелочами: СО + NaOH(кр.) COCl2↑ (фосген – сильный яд!)
*5) Со щелочами: СО + NaOH(кр.)  HCOONa (формиат натрия) HCOONa (формиат натрия)
|
| Применение: 1) В металлургии для получения чистых металлов. 2) В органическом синтезе для получения синтетического углеводородного сырья. 3) Для получения карбонилов металлов (никеля, кобальта и железа), которые используются как катализаторы в органическом синтезе. |
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ ОКСИДЕ УГЛЕРОДА(IV)
| СO2 – углекислый газ, угольный ангидрид, диоксид углерода |
Получение:
В промышленности
1) Прямой синтез: С + O2  СO2↑
2) Сжигание метана и других органических соединений:
СН4 + 2О2 СO2↑
2) Сжигание метана и других органических соединений:
СН4 + 2О2  СO2↑ + 2H2O
3) Разложение карбонатов: СаСO3 СO2↑ + 2H2O
3) Разложение карбонатов: СаСO3  СаO + СO2↑
В лаборатории
4) Взаимодействием карбоната кальция с кислотой:
СаСO3 + 2HCl → CO2↑ + H2O + CaCl2
5) Окисление угарного газа: 2СO + O2 → 2СO2↑ СаO + СO2↑
В лаборатории
4) Взаимодействием карбоната кальция с кислотой:
СаСO3 + 2HCl → CO2↑ + H2O + CaCl2
5) Окисление угарного газа: 2СO + O2 → 2СO2↑
|
| Физические свойства: Газ без цвета и запаха, слабо растворим в воде. При низких температурах и давлении превращается в белую льдоподобную кристаллическую массу – «сухой лёд». Сухой лёд опасен – легко обжигает кожу. В 1,52 раза тяжелее воздуха. Не горит и не поддерживает дыхание и горение. В мизерных дозах не опасен, но при содержании в воздухе более 10 % смертельно опасен. |
Химические свойства:
Солеобразующий кислотный оксид
1) С водой: СO2 + H2O ⇄ [H2CO3] ⇄ СО2∙Н2О
(угольная кислота) (гидрат углекислого газа)
2) Со щелочами: СO2 + NaOH → NaНСO3 (гидрокарбонат натрия)
СO2 + 2NaOH → Na2СO3+ H2O
3) С основными оксидами: СO2 + Na2O → Na2СO3 (карбонат натрия)
4) Образование угарного газа: СO2 + С 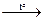 2СО↑
*5) Окисление магния: СO2 +2Mg 2СО↑
*5) Окисление магния: СO2 +2Mg 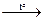 2MgO + С (поэтому нельзя тушить горящий магний углекислым газом)
6) Превращение карбоната в гидрокарбонат:
СаСО3 + СO2 + H2O → Са(НCO3)2 (гидроарбонат кальция) 2MgO + С (поэтому нельзя тушить горящий магний углекислым газом)
6) Превращение карбоната в гидрокарбонат:
СаСО3 + СO2 + H2O → Са(НCO3)2 (гидроарбонат кальция)
|
| Применение: 1) Для получения соды, сахара, газированных напитков. 2) Для тушения пожаров в огнетушителях. 3) Сухой лед используют при взрывных работах, для устранения облачности, а также при хранения продуктов. |
 2020-05-13
2020-05-13 424
424







