Общая характеристика неметаллов
А) Положение неметаллов в периодической системе
Неметаллы - элементы, атомы которых обладают неметалличностью, т.е. способностью принимать электроны. Известно 22 неметалла. Они расположены в правом верхнем углу ПСХЭ, из них 6 – инертные газы.
Элементы с неметаллическими свойствами находятся в III-VII - группах главных подгруппах Периодической системы:
- НЕМЕТАЛЛЫ VIII ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (БЛАГОРОДНЫЕ ГАЗЫ): гелий, неон, аргон, криптон, ксенон, радон.
- НЕМЕТАЛЛЫ VII ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ГАЛОГЕНЫ): фтор,хлор, бром, йод, астат.
- НЕМЕТАЛЛЫ VIГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ХАЛЬКОГЕНЫ): кислород, сера, селен, теллур.
- НЕМЕТАЛЛЫ V ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ПОДГРУППА АЗОТА): азот, фосфор, мышьяк.
- НЕМЕТАЛЛЫ IVГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ПОДГРУППА УГЛЕРОДА): углерод, кремний.
Б) Особенности атомного строения неметаллов:
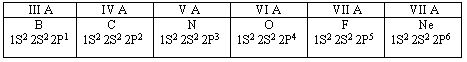
1. Небольшой атомный радиус;
2. На внешнем уровне 4-8 электронов (исключение водород – 1 электрон, гелий – 2 электрона);
3. Характерно высокое значение ЭО;
4. Степени окисления от -4 до +8.
В) Строение простых веществ неметаллов
Неметаллы -простые вещества, образованные элементами неметаллами и обладающие характерными неметаллическими свойствами: отсутствие металлического блеска, неэлектропроводность и т.д.
Вид химической связи – ковалентная неполярная.
Тип кристаллической решётки – атомная, молекулярная.
1. АТОМАРНОЕ СОСТОЯНИЕ: Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии (He –гелий, Ne-неон, Ar-аргон, Kr-криптон, Xe-ксенон, Rn-радон
2. АТОМНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ: алмаз (С) и кремний (Si)
3. МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
Многие неметаллы образуют молекулу, состоящую из двух атомов
(H2, O2, N2, F2, Cl2, Br2, I2)..
Физические свойства неметаллов
При обычной температуре неметаллы могут быть в разном агрегатном состоянии.
1. Газообразные - O2-кислород, H2 - водород, N2- азот, Cl2-хлор, F2-фтор.
2. Жидкие - Br2 -бром
3. Твердые: S8 –ромбическая сера, P4-бедый фосфор, I2- йод, C - алмаз и графит
Многие не проводят электрический ток (кроме графита-C и кремния-Si).
Не проводят тепло.
В твердом состоянии - хрупкие.
Не имеют металлического блеска (кроме иода-I2, графита-C и кремния-Si)
Цвет охватывает все цвета спектра: красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода.
Температура плавления изменяется в огромном интервале: tпл (N2)= -210⁰C, а tпл (алмаз) =3730⁰С
АЛЛОТРОПИЯ - способность атомов одного химического элемента образовывать несколько простых веществ, а эти простые вещества – аллотропными видоизменениями или модификациями.
КИСЛОРОД
Элемент кислород образует две аллотропные модификации
Кислород - O₂: Газ без цвета и запаха. Входит в состав воздуха (21% по объему). Не ядовит!
Озон - O3: Газ бледно-фиолетового цвета с резким запахом свежести. Ядовит!
Обладает бактерицидными свойствами.
СЕРА
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип = 445 °С
У серы можно выделить три аллотропных модификации: кристаллическая(ромбическая), моноклинная и пластическая.
Переход из кристаллической в пластическую происходит при нагревании до температуры кипения при последующем быстром охлаждении.
АЗОТ
Азот – газ без цвета и запаха, плохо растворим в воде. Азот является основной частью воздуха (79% по объѐму).
ФОСФОР
Образует трдве аллотропные модификации.
Фосфор белый P₄( молекулярная кристаллическая решётка)
Мягкое, бесцветное вещество. В темноте светится. Ядовит!
Фосфор красный Pn (атомная кристаллическая решётка) аморфное
полимерное вещество(порошок) тёмно-красного цвета. В темноте не светится, ядовит!
УГЛЕРОД
Образует две аллотропные формы.
Алмаз: Тетраэдрическая кристаллическая решетка
Бесцветные кристаллы. Самое твердое вещество в природе. tпл=3730ºC
Графит: Кристаллическая решетка напоминает соты.
Слоистое кристаллическое вещество, жирное на ощупь, непрозрачное,серого цвета.
 2020-05-13
2020-05-13 1869
1869







