Андреева, Наталья Александровна
Подготовка к вступительному экзамену по химии. Теоретические основы химии : учебное пособие / Н. А. Андреева, С. В. Вихман ; Министерство науки и высшего образования Российской Федерации, Санкт-Петербургский государственный технологический институт (технический университет), Кафедра химической технологии тугоплавких неметаллических и силикатных материалов. - Санкт-Петербург : СПбГТИ(ТУ), 2019.
Ч. 1. - 2019. - 87 с. - Библиогр.: с. 84.
Тема 1. Строение атомов
С точки зрения химии, атом – это наименьшая частица элемента, сохраняющая его химические свойства. Свойства элементов определяются внутренним строением их атомов.
Приведем упрощенно (в рамках школьной программы) современные представления о строении атома.
1. Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
2. Ядро расположено в центре атома, размер ядра примерно в 100000 раз меньше размера атома, но практически вся масса атома сосредоточена в ядре.
3. Ядра атомов состоят из протонов и нейтронов.
4. Вокруг ядра на значительном расстоянии по определенным орбиталям вращаются электроны.
Приведем в сравнении массу и заряд протонов, нейтронов и электронов (таблица 1).
Таблица 1 – Масса и заряд элементарных частиц
|
Частица |
Обозначение |
Масса |
Заряд |
|
| кг | а.е.м. | |||
| Протон | p | 1,6726⋅10−27 | 1 | +1 |
| Нейтрон | n | 1,6749⋅10−27 | 1 | 0 |
| Электрон | ? | 9,11⋅10−31 | ~ 1/1800 | –1 |
Массу элементарных частиц, а также и массу атомов и молекул, удобно выражать в атомных единицах массы (а.е.м.). Атомная единица массы (она же углеродная единица) определяется как 1⁄12 массы атома углерода 12C,
1 а.е.м. = 1,66⋅10−27 кг (по сути это среднеарифметическое масс протона и нейтрона).
Из таблицы 1 видно, что заряд ядра определяется количеством протонов, и поскольку атом в целом электронейтрален, число электронов равно заряду ядра или числу протонов. Масса атома определяется т.н. массовым числом – суммой протонов и нейтронов в ядре, масса электронов ничтожно мала.
Химический элемент – совокупность атомов с одинаковым зарядом ядра. Каждый химический элемент обозначается своим символом. Элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом оганесона, в ядре которого 118 протонов. Количество протонов в ядре (заряд ядра) совпадает с порядковым номером элемента в Периодической системе химических элементов Д.И. Менделеева.
У всех атомов одного элемента одинаковое число электронов и одинаковые химические свойства. Именно число электронов и их расположение относительно ядра определяет химические свойства элементов. В то же время химические свойства элемента почти не зависят от его массового числа – атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии (далее – Кодификатор) [1] предполагает знание строения электронных оболочек атомов элементов первых четырех периодов.
Рассмотрим строение атома первого элемента периодической системы водорода. Ядро атома водорода содержит один протон, электрон преимущественно находится в сферическом слое вокруг атомного ядра, образуя так называемую электронную оболочку (рисунок 1).
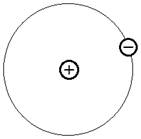
Рисунок 1 – Строение атома водорода
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства около ядра, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Второй элемент гелий содержит в ядре два протона. Возможность нахождения двух положительно заряженных протонов в ограниченном пространстве ядра обусловлена наличием в ядре нескольких нейтронов – силы притяжения нескольких частиц превышают силы отталкивания двух одноимённо заряженных протонов.
Количество нейтронов может быть разное, даже некоторые атомы водорода содержат нейтроны. Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Изотопы обозначаются символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число, например, 14C, 235U, читается как углерод-14, уран-235. Изотопы водорода имеют собственные названия: 2Н – дейтерий, 3Н – тритий.
Электроны в атоме различаются своей энергией. Электроны с близкими значениями энергии образуют электронные слои, которые называют также энергетическим уровнем.
В атомах водорода и гелия имеется только один энергетический уровень, первый, на нем располагается один или два электрона. Эти электроны обладают наименьшей энергией, они прочно связаны с ядром. Чем меньше энергия электрона, тем сильнее он притягивается к ядру и тем меньше по размерам его орбиталь.
Согласно квантовой механики на каждом энергетическом уровне может находится не более 2 n 2 электронов. На ближайшем к ядру первом уровне может находится максимально 2×12 – два электрона. В атоме гелия уровень заполнен, а в следующем атоме – атоме лития, появляется второй энергетический уровень. Емкость второго уровня – 2×22 = 8 электронов. Такое количество электронов не могут занимать одно сферическое пространство – уровни, начиная со второго, разделяются на подуровни. Электроны на подуровнях различаются по энергии и по траектории движения. Каждый энергетический уровень в атоме начинается со сферических s -орбиталей. На втором и последующих уровнях после одной s -орбитали появляются три р -орбитали гантелеобразной формы. Начиная с третьего уровня после s - и p - орбиталей располагаются 5 d -орбиталей сложной формы (рисунок 2). На любой орбитали может разместится не более двух электронов: на s -орбитали их может быть только два, на трёх р -орбиталях – шесть, на пяти d -орбиталях – десять (таблица 2).
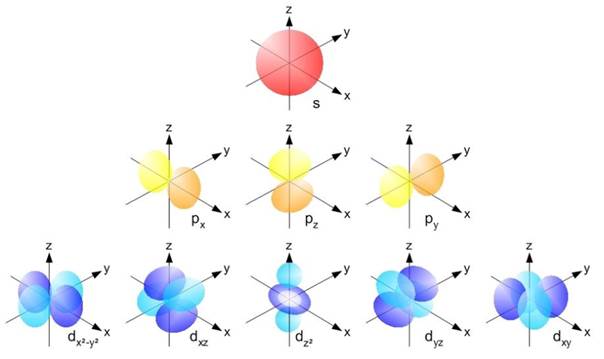
Рисунок 2 – Формы s-, р- и d -орбиталей*
Таблица 2 – Энергетические уровни и подуровни
| Энергетические уровни | Энергетические подуровни | Число электронов |
| 1 | 1 s | 2 |
| 2 | 2 s 2 p | 2 6 |
| 3 | 3 s 3 p 3 d | 2 6 10 |
| 4 | 3 s 3 p 3 d 4 f | 2 6 10 14 |
Чем дальше от ядра, тем больше энергия электрона. Наиболее устойчивое состояние атома, в котором все электроны занимают места с наименьшей энергией, называется основным состоянием. Любые другие состояния называются возбужденными (возникают при активации светом, нагревом, взаимодействии с другим атомом и т.п.).
 2020-05-11
2020-05-11 408
408







