1. Электроны занимают орбиталь, обладающую наименьшей энергией. Расчеты показывают, что энергия многоэлектронных d - и f - подуровней больше, чем s - и p - подуровней следующих за ними электронных уровней, поэтому после заполнения 3 p подуровня заполняется подуровень 4 s, а не 3 d, а подуровень 4 d заполняется после 5 s. Этот материал подробно разбирается в курсе химии высших учебных заведений. Сейчас нужно запомнить, что последовательность заполнения электронами орбиталей следующая
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ® 4 d ® 5 p ® 6 s …
2. На каждой орбитали может находится один электрон или два электрона. Если на орбитали находится один электрон, он называется неспаренный, если два электрона – спаренные (рисунок 3).
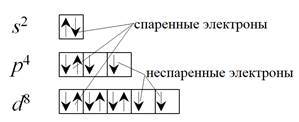
Рисунок 3 – Спаренные и неспаренные электроны
3. На орбиталях с одинаковой энергией располагается как можно больше неспаренных электронов (электронные облака максимально расталкиваются), рисунок 4.
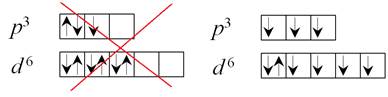
Рисунок 4 – Распределение электронов по ячейкам
Используя для обозначения уровня цифры, для обозначения подуровней буквы s, р и d, а число электронов – цифрой вверху справа над буквой, записывают так называемые электронные формулы атомов.
Приведем электронные формулы атомов первых четырех периодов:
1H 1 s 1
2He 1 s 2
3Li 1 s 2 2 s 1
4Be 1 s 2 2 s 2
5B 1 s 2 2 s 2 2 p 1
6C 1 s 2 2 s 2 2 p 2
7N 1 s 2 2 s 2 2 p 3
8O 1 s 2 2 s 2 2 p 4
9F 1 s 2 2 s 2 2 p 5
10Ne 1 s 2 2 s 2 2 p 6
11Na 1 s 2 2 s 2 2 p 6 3 s 1
12Mg 1 s 2 2 s 2 2 p 6 3 s 2
13Al 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
14Si 1 s 2 2 s 2 2 p 6 3 s 2 3 p 2
15P 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3
16S 1 s 2 2 s 2 2 p 6 3 s 2 3 p 4
17Cl 1 s 2 2 s 2 2 p 6 3 s 2 3 p 5
18Ar 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
19K 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1
20Ca 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2
21Sc 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 1 4 s 2
22Ti 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 2 4 s 2
23V 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 3 4 s 2
24Cr 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1! Это состояние более устойчиво, чем 3 d 4 4 s 2
25Mn 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 2
26Fe 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 6 4 s 2
27Co 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 7 4 s 2
28Ni 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 8 4 s 2
29Cu 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1! Это состояние более устойчиво, чем 3 d 94 s 2
30Zn 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2
31Ga 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 3 p 1
32Ge 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 3 p 2
33As 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 3 p 3
34Sc 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 3 p 4
35Br 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 3 p 5
36Kr 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 3 p 6
 2020-05-11
2020-05-11 417
417








