3.2.1 Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний–никель. Какие продукты коррозии образуются в первом и втором случаях?
Поскольку магний имеет меньшую величину электродного потенциала (–2,37 В), чем никель (–0,25 В), то он будет играть роль анода, а никель – роль катода. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация), или ионов водорода, присутствующего в кислой среде (водородная деполяризация).
Электродные процессы, протекающие в нейтральной среде:
А) Mg0 – 2ē → Mg2+ – процесс окисления;
К) 2Н2О + О2 + 4ē → 4ОН– – процесс восстановления.
Образующиеся ионы магния связываются с гидроксид-ионами, с образованием гидроксида магния:
Mg2+ + 2ОН– → Mg(ОН)2 – продукт коррозии в нейтральной среде.
Схема работы данного гальванического элемента:
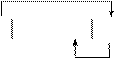 |
Mg H2O, О2 Ni.
Электродные процессы, протекающие в кислой среде:
А) Mg0 – 2ē → Mg2+ – процесс окисления;
К) 2Н+ + 2ē → Н2 – процесс восстановления.
Поскольку не указана кислота, в которую погружена гальванопара магний – никель, то будем считать, что продуктом коррозии в кислой среде является соль магния (Mg2+).
Схема работы данного гальванического элемента:
 |
Mg H+ Ni.
3.2.2 Каким покрытием по отношению к железу является никель? Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов, протекающих в растворе хлорида натрия. Каков состав продуктов коррозии?
Раствор хлорида натрия имеет нейтральную реакцию среды. Функция NaCl заключается в ускорении процесса коррозии.
Поскольку железо имеет меньшую величину электродного потенциала (–0,44 В), чем никель (–0,25 В), то оно будет играть роль анода, а никель – роль катода. Следовательно, покрытие никелем будет являться катодным по отношению к железу.
При нарушении никелевого покрытия на железе самопроизвольно возникает гальванический элемент. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация).
Электродные процессы:
А) Fe0 – 2ē → Fe2+ – процесс окисления;
К) 2Н2О + О2 + 4ē → 4ОН– – процесс восстановления;
Fe2+ + 2ОН– → Fe(ОН)2.
Гидроксид железа Fe(ОН)2 является неустойчивым соединением, поэтому в нейтральной среде протекает процесс его доокисления:
4Fe(ОН)2 + 2Н2О + О2 → 4Fe(ОН)3.
Далее происходит процесс отщепления молекул воды и образование оксид-гидроксида:
Fe(ОН)3 → FeООН + Н2О;
2FeООН → Fe2О3 + Н2О.
Состав продуктов коррозии будет следующим: Fe(ОН)2, Fe(ОН)3, FeООН, Fe2О3.
Схема работы данного гальванического элемента:
 |
Fe H2O, О2, NаCl Ni.
 2020-05-21
2020-05-21 105
105