ХИМИЯ
Методические рекомендации к практическим занятиям
Для студентов всех специальностей
Дневной и заочной форм обучения
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
КОРРОЗИЯ МЕТАЛЛОВ.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ

Могилев 2019
| |
ББК 24.1
Х 46
Рекомендовано к опубликованию
Центром менеджмента качества образовательной деятельности
ГУ ВПО «Белорусско-Российский университет»
Одобрено кафедрой «Технологии металлов» «27» февраля 2019 г., протокол № 8
Составители: канд. биол. наук, доц. И. А. Лисовая;
канд. хим. наук, доц. И. М. Лужанская
Рецензент д-р физ.-мат. наук, доц. А. В. Хомченко
В методических указаниях приведены примеры написания электродных процессов, составления схем работы гальванических элементов, решения некоторых задач, контрольные вопросы и упражнения.
Учебное издание
ХИМИЯ
Ответственный за выпуск Д. И. Якубович
Технический редактор А А. Подошевко
Компьютерная верстка Н. П. Полевничая
Подписано в печать . Формат 60×84/16. Бумага офсетная. Гарнитура Таймс. Печать трафаретная. Усл.-печ. л. . Уч.-изд. л. . Тираж 71 экз. Заказ №
Издатель и полиграфическое исполнение:
Государственное учреждение высшего профессионального образования
«Белорусско-Российский университет».
Свидетельство о государственной регистрации издателя,
изготовителя, распространителя печатных изданий
№ 1/156 от 24.01.2014.
Пр. Мира, 43, 212000, Могилев.
© ГУ ВПО «Белорусско-Российский
университет», 2014
Гальванические элементы
В узлах металлической кристаллической решетки располагаются положительно заряженные ионы, находящиеся в равновесии со свободными электронами. При погружении металла (Ме) в раствор начинается взаимодействие поверхностных ионов металла (Men+), находящихся в узлах решетки, с полярными молекулами воды. При этом ионы металла переходят из металлической фазы в раствор.
В результате между металлом и раствором устанавливается равновесие:
 Me + mH2O Me n+ ∙ m H2O + nē,
Me + mH2O Me n+ ∙ m H2O + nē,
в растворе на металле
где n – число электронов, принимающих участие в процессе.
Если преобладает переход ионов из металлической фазы в раствор, то раствор приобретает положительный заряд (рисунок 1, а), а металлический электрод заряжается отрицательно. Если при установлении контакта «металл–раствор» скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном направлении, то между электродом и раствором также устанавливается равновесие, но в этом случае электрод заряжается положительно, а раствор – отрицательно (рисунок 1, б).
Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В любом случае появляется двойной электрический слой, характеризующийся определенным скачком потенциала.
а) б) в)

Рисунок 1 – Схема двойного электрического слоя (а) и (б), распределение заряда в объеме электролита (в)
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. В настоящее время абсолютные значения электродных потенциалов на границе двух фаз разной природы «металл – электролит» экспериментально определить невозможно. Однако можно определить разность электродных потенциалов.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях.
Таким образом, стандартным электродным потенциалом Е0 металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю.
Величина возникающего в результате этого процесса электродного потенциала определяется по уравнению Нернста:
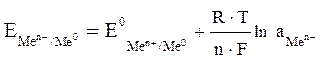 ,
,
где  – электродный потенциал;
– электродный потенциал;
 – стандартный электродный потенциал;
– стандартный электродный потенциал;
R – газовая постоянная;
Т – температура;
F – число Фарадея;
n – число электронов, участвующих в электронной реакции;
а – активная концентрация ионов металла в растворе.
Потенциал электрода, как видно из этого уравнения, зависит от активности (концентрации) ионов металла, от природы электролита, от природы электрода, от заряда иона и от температуры.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, Rи T = 298 K, а также заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
 .
.
Значения некоторых стандартных окислительно-восстановительных потенциалов гальванических элементов, расположенных в порядке возрастания их алгебраической величины, представлены в ряду стандартных электродных потенциалов – СЭП (ряду напряжения).
Выводы из ряда СЭП.
1 Чем меньше значение Е0, тем более сильные восстановительные свойства проявляет простое вещество – металл (и тем легче он электроны отдает). Чем больше значение Е0, тем более сильным окислителем в водном растворе являются ионы металла (и тем легче они принимают электроны).
2 Активные металлы начала ряда вытесняют водород из воды. Магний вытесняет водород только из горячей воды.
Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием. В некоторых случаях возможно протекание процесса в случае нагревания или разрушения защитной оксидной пленки. Например:
а) 2Na + 2H2O → 2NaOH + Н2↑;
t
б) Mg + 2H2O → 2Mg(OH)2 + Н2↑;
в) 3Fe + 4H2O → Fe3O4 + 4Н2↑;
г) Zn + 2H2O + 2KOH → K2[Zn(OH)4] + Н2↑.
Металлы, расположенные в ряду СЭП после водорода, с водой в отсутствии окислителей не взаимодействуют.
3 Водород из кислот не окислителей способны вытеснять только те металлы, которые имеют отрицательную величину стандартного водородного электрода и расположены в ряду СЭП до (выше) водорода. Металлы, расположенные в ряду СЭП после водорода, с растворами кислот не взаимодействуют. Например:
Мg + 2HCl → MgCl2 + H2↑ или в ионной форме Мg0 + 2H+ → Mg2+ + H20↑
 Ag + HCl →.
Ag + HCl →.
При этом на поверхности некоторых металлов образуются защитные пленки, тормозящие реакцию. Так, оксидная пленка на алюминии делает этот металл стойким не только в воде, но и в растворах некоторых кислот. Явление глубокого торможения окисления металла, обусловленное наличием на его поверхности защитных оксидных или солевых пленок, называется пассивностью, а состояние металла при этом – пассивным состоянием.
4 Металлы способны вытеснять друг друга из растворов солей. Рассматривая конкретные случаи таких реакций, следует помнить, что активные металлы вытесняют водород не только из воды, но и из любого водного раствора. Поэтому взаимное вытеснение металлов из растворов их солей практически происходит лишь в случае металлов, расположенных в ряду после магния. То есть, металл с более отрицательным значением стандартного электродного потенциала является восстановителем по отношению к электроду с более положительным значением E0.
Таким образом, металлы средней химической активности, стоящие в ряду СЭП выше, вытесняют нижестоящие из их солей. Например:
Мg + Ni(NO3)2 → Mg(NO3)2 + Ni
или в ионной форме Мg0 + Ni2+ → Mg2+ + Ni0.
Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами.
В простейшем случае гальванический элемент состоит из двух пластин или стержней (электродов первого рода), изготовленных из различных металлов (окислительно-восстановительных пар), погруженных в раствор электролита (чаще – это раствор соли металла).
Электрод, на котором происходит процесс окисления (анодный процесс), называется анодом. Роль анода играет металл с меньшей алгебраической величиной электродного потенциала, т. е. более активный металл. Электрод, на котором осуществляется восстановление (катодный процесс), называется катодом (металл с большей алгебраической величиной электродного потенциала).
Рассмотрим в качестве примера медно-цинковый гальванический элемент (элемент Якоби-Даниэля). Этот элемент (рисунок 2) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод).
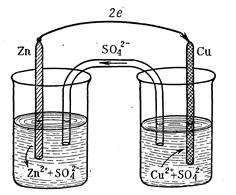 а) б)
а) б)

а – с растворами, соприкасающимися друг с другом; б – с изолированными растворами
Рисунок 2 – Схема гальванического элемента Якоби-Даниэля
Оба раствора или соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала (см. рисунок 2, а), или не соприкасаются, но взаимосвязь между ними осуществляется посредством проводника второго рода (электролитного мостика (см. рисунок 2, б).
Работа гальванического элемента при замыкании цепи начинается с того, что электрод, изготовленный из более активного металла, в данном случае из цинка, взаимодействует с полярными молекулами воды, находящимися в соприкасающемся с поверхностью электрода растворе, по уравнению
Zn0 + n Н2О → Zn2+∙ n Н2О + 2ē
или в упрощенной форме Zn0 – 2ē → Zn2+.
Образовавшиеся гидратированные катионы цинка переходят в раствор, а электроны заряжают отрицательно поверхность электрода. В этом заключается первая стадия работы гальванического элемента – возникновение источника отрицательного электричества.
Осуществляется отвод высвобождающихся при этом электронов по внешней цепи с анода на катод в результате соединения цинкового электрода проволокой с медным электродом. В этом заключается вторая стадия работы гальванического элемента – прохождение электрического тока по проводнику.
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися катионами меди. Образуются атомы меди, выделяющиеся в виде металла:
Cu 2+∙nН2О + 2ē → Cu0 + nН2О
или в упрощенной форме Cu2+ + 2ē → Cu0.
Таким образом, на медном электроде идет процесс восстановления меди. В этом заключается третья стадия работы гальванического элемента – разрядка ионов на катоде. Все три стадии работы гальванического элемента сопряжены между собой и идут с одинаковой скоростью.
Суммарное уравнение реакции, протекающей в элементе (токообразующей реакции), получится при сложении уравнений обеих полуреакций:
Zn0 + Cu2+ → Zn2+ + Cu0
или в молекулярной форме Zn + CuSO4 → ZnSO4 + Cu.
У цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе (Сu2+ и Zn2+), движутся от цинкового электрода к медному, а анионы SO42– – в обратном направлении. Движение ионов SO42– в растворе замыкает электрическую цепь гальванического элемента (например, если убрать электролитный мостик (см. рисунок 2, б), то электрический ток по внешнему проводнику протекать не будет).
Таким образом, при замыкании внешней цепи, т. е. при соединении цинка с медью металлическим проводником, возникают самопроизвольные процессы растворения цинка (как более активного металла) на аноде и выделения меди (как менее активного металла) из раствора на катоде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не восстановится на медном электроде вся медь).
При схематическом изображении гальванического элемента граница раздела фаз между металлом и раствором обозначается одной вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой, которая отделяет анодное пространство от катодного. Слева записывается анод ZnôZn2+, на котором возникает избыток электронов и происходит процесс окисления. Справа – катод Cu2+ôCu – электрод с недостатком электронов. Стрелками показано направление движения электронов во внешней цепи гальванического элемента.
Например, схема гальванического элемента Якоби-Даниэля изображается следующим образом (молекулярная форма):
2ē
Zn ô ZnSO4 ôô CuSO4 ô Cu. |
Эта же схема может быть изображена в ионной форме:
2ē
Zn ô Zn2+ ôô Cu2+ ô Cu. |
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором электродвижущая сила (ЭДС) элемента имеет положительное значение. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу электрода-окислителя минус электродный потенциал электрода-восстановителя.
ЭДС гальванического элемента определяется как разность электродных потенциалов катода и анода:
ЭДС = ЕК – ЕА.
В случае элемента Якоби-Даниэля (–) ZnôZn2+||Cu2+ôCu(+) для стандартных условий
ЭДС = Е0Cu – Е0Zn = 0,34 – (–0,76) = 1,1 В.
Для нестандартных условий ЭДС элемента Якоби-Даниэля находится из разности электродных потенциалов, вычисленных по уравнению Нернста.
Коррозия металлов
Коррозия металлов – самопроизвольное разрушение металлов и изделий из них вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам безвозвратные потери металла от коррозии составляют 10–15 % мировой продукции стали.
В основе коррозийных процессов лежат окислительно-восстановительные реакции металлов с окружающей средой, сопровождающиеся переходом металлов в более термодинамически устойчивое состояние.
Среда, в которой металл подвергается коррозии (коррозирует), называется коррозионной или агрессивной средой. В зависимости от уровня рН выделяют коррозию в трех средах: кислой, щелочной и нейтральной.
 2020-05-21
2020-05-21 272
272









