ИДЕАЛЬНЫЙ ГАЗ
Понятие идеального газа
Как отмечалось в разд. 2, состояние ТД системы с фиксированным числом частиц определяется тремя её параметрам состояния: р, V и Т, причём эти параметры не являются независимыми. а связаны некоторым соотношением:
f (p, V,Т) = 0, (3.1)
которое называется уравнением состояния системы. Его конкретный вид зависит от свойств системы. Простейшей ТД системой является идеальный газ.
Определение. Газ, взаимодействия между молекулами которого сводятся к упругим столкновениям, называется идеальным. Внутренняя энергия идеального газа − это только кинетическая энергия хаотического движения его молекул.
Всякий реальный газ при достаточном разрежении близок по свойствам к идеальному. При комнатной температуре и атмосферном давлении такие газы, как кислород, азот, а особенно водород и гелий очень близки по свойствам к идеальному. Но такие газы, как Н2О и СО2 при тех же условиях уже заметно отличаются от идеального.
Закон Авогадро
В 1811 году Авогадро из опытов установил следующий факт, сформулированный в виде закона: при одинаковых давлении р и температуре Т один моль любого идеального газа занимает одинаковый объём. В частности. при нормальных условиях, т. е. при р = 1 атм = 1,013·105 Па и Т = 273,15 К = 0°С, один моль идеального газа (содержащий N А = 6·1023 молекул) занимает объём
VM = 22,4 литра = 2,24·10−2 м3/моль
(молярный объём).
Уравнение состояния идеального газа
На основе опытов Бойля установлено, что для одного моля идеального газа общее уравнение состояния (3.1) имеет следующий конкретный вид:
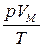 = const = R, (3.2)
= const = R, (3.2)
где р – давление газа, VM – молярный объём, Т – температура, R – некоторая константа, называемая газовой постоянной. Её значение можно найти из закона Авогадро, подставив в (3.2) р = 1,01·105 Па, VM = 2,24·10−2 м3/моль, Т = 273 К. Это даёт: R = 8,31 Дж/(моль·К).
А так как объём ν молей газа V = ν VM, то уравнение (3.2) для произвольного количества идеального газа примет вид
pV = ν RT, (3.3)
или
pV =  , (3.4)
, (3.4)
где m – масса газа, М (кг/моль) – его молярная масса, ν = m/M – число молей.
Теперь можно дать следующее функциональное определение идеального газа: всякий газ, состояние которого описывается уравнением (3.3), называется идеальным.
Уравнение состояния идеального газа в форме (3.3) или (3.4) называется уравнением Клапейрона-Менделеева. Его можно представить в следующей эквивалентной форме: так как ν = N/N A, то из (3.3) получаем
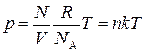 ,
,
где k = R/N А = 1,38·10−23 Дж/К – постоянная Больцмана, п = N/V – концентрация молекул газа.
 2020-05-21
2020-05-21 125
125







