Так как теплота Q не является функцией состояния системы, а зависит от условий нагрева, то и молярная теплоёмкость С тоже зависит от условий нагрева: нагрев при V = const, нагрев при р = const или при других условиях. Таким образом, «теплоёмкость вообще» определённого значения для газа не имеет: в зависимости от условий нагрева, теплоёмкость С может принимать любое значение от 0 до ∞, и даже может быть отрицательной.
Рассмотрим два варианта нагрева идеального газа: при постоянном объёме и при постоянном давлении. Соответствующие этим условиям молярные теплоёмкости будем обозначать СV и С р:
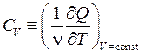 ,
,  .
.
Вариант 1: V = const (газ нагревают в жёстком баллоне (рис. 3.1)).
 Так как
Так как
dQ = (pdV + dU) V = const = dU = (i/ 2)ν RdT,
то
СV = 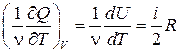
(здесь берётся полная производная, так как U имеет единственный аргумент Т). Таким образом,
dU = ν CV dT, (3.9)
где ν = m / M – число молей газа, СV = (i / 2) R – молярная теплоёмкость при постоянном объёме. И тогда первый закон термодинамики для элементарных процессов можно записать в виде:
dQ = pdV + ν CVdT. (3.10)
Замечание. Уравнение (3.9) легко интегрируется:
U = ν CVT + U 0,
 где U 0 – константа интегрирования, которая представляет собою внутреннюю энергию газа при Т = 0. Её можно положить равной нулю, так как при Т = 0 хаотического движения молекул нет (υ = 0). Таким образом, U 0 = 0, и внутренняя энергия идеального газа U = ν CV T (Дж).
где U 0 – константа интегрирования, которая представляет собою внутреннюю энергию газа при Т = 0. Её можно положить равной нулю, так как при Т = 0 хаотического движения молекул нет (υ = 0). Таким образом, U 0 = 0, и внутренняя энергия идеального газа U = ν CV T (Дж).
Вариант 2: р = const (газ нагревают в цилиндре под тяжёлым поршнем (рис. 3.2)).
Так как
dQ = pdV + ν CV dT,
то
Ср =  .
.
Но из уравнения состояния (3.3) при р = const следует, что
pdV = ν RdT,
и тогда
Ср = СV +  .
.
Таким образом, Ср всегда больше СV. Это объясняется тем, что при V = const тепло Q идёт только на нагрев газа, а при р = const – ещё и на совершение газом работы А при увеличении его объёма. Так как СV =(i/ 2) R, то
Ср = СV + R =  .
.
Поскольку pdV = ν RdT, то первый закон термодинамики теперь может быть записан не только в виде (3.10), но и в виде
dQ = pdV + ν CV dT = ν RdT+ ν CV dT = ν Cр dT.
 2020-05-21
2020-05-21 133
133







