Чтобы установить взаимосвязь между эмпирически найденной величиной 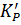 и термодинамическими константами
и термодинамическими константами 
 (Ко) следует выразить парциальные давления каждого компонента в долях от стандартного (1 атм.). С учётом этого приходим к выражению:
(Ко) следует выразить парциальные давления каждого компонента в долях от стандартного (1 атм.). С учётом этого приходим к выражению:

И аналогично можно вывести уравнения, связывающие термодинамическую константу и константы, выраженных через равновесные концентрации, мольные доли и количество моль реагентов.
Равновесия в гетерогенных процессах
Реакции называются гетерогенными, если реагирующие вещества находятся в разных фазах. В простейшем случае имеющиеся конденсированные фазы практически нерастворимы друг в друге. Тогда активности конденсированных фаз принимаются равными единице, а активности компонентов газовой фазы – их парциальным давлениям (или летучести, когда давления сопоставимы с критическими).
Примером простой гетерогенной реакции является термическая диссоциация карбоната кальция:
CaCO3(тв)=СaO(тв)+СО2(г)
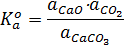
 ;
;  .
.  тогда
тогда  .
.

То есть термодинамическая константа численно равна равновесному давлению СО2, выраженному в атмосферах.
Стандартные условия, когда давление равно стандартному, т.е.

А газы, участвующие в реакции, являются идеальными.
 2020-05-25
2020-05-25 311
311







