Нативное состояние белка ассоциируется с компактным глобулярным состоянием, а денатурированное с полностью развернутым состоянием, напоминающим состояние клубка для синтетических полимеров в хорошем растворителе. Представление о том, что в нативном состоянии белок имеет жесткую, строго упорядоченную структуру, нашло подтверждение в экспериментально установленной способности глобулярных белков в нативном состоянии образовывать кристаллы. Эго обстоятельство позволило определить пространственную структуру многих белков вплоть до координат отдельных атомов методом рентгеноструктурного анализа. Первыми были определены пространственные структуры гемоглобина и миоглобина, а затем многих тысяч других белков. На основании этих работ сложилось представление о нативном белке как о жесткой, строгой детерминированной структуре.
Процесс образования белков в клетке состоит из двух этапов: биосинтеза полипептидной цепи и образования нативного состояния, т. е. достижения полипептидной цепью состояния, в котором белок становится функционально активным. Первый этап — сборка аминокислотной последовательности на основе информации, хранящейся в DNA. Хотя этот процесс и является очень сложным, он хорошо изучен. Второй этап — формирование нативной структуры белка — изучен в значительно меньшей степени, и именно к нему в настоящее время приковано основное внимание исследователей.
В основе процесса укладки полипептидной цепи в пространстве лежат механизмы специфического узнавания определенных поверхностей, образуемых порой тысячами атомов, с участием кооперативного взаимодействия большого числа относительно слабых нековалентных связей. Этот процесс направлен на достижение наиболее термодинамически устойчивой конформации, обладающей минимумом свободной энергии.
Какое же состояние возникает после достижения молекулой минимума свободной энергии? Будет ли оно нативным? Для того чтобы ответить на эти вопросы, необходимо вспомнить о существовании еще одного фундаментального закона природы биологического закона об эволюционном отборе. Аминокислотная последовательность должна быть такой, чтобы по достижении ею состояния, отвечающего минимуму свободной энергии, белок становился функционально активным — нативным. «Бессмысленные» аминокислотные последовательности, которые в состоянии, отвечающем минимуму свободной энергии, не выполняют никакой функции, должны быть отметены эволюционным отбором.
Количество возможных конформаций полипептидной цепи велико. Для цепи в 100 аминокислот (относительно небольшой белок), например, существует около 1050 различных конформаций. Как может белок найти самые устойчивые из них за 1 с (типичный период сворачивания молекулы), остается одной из самых интригующих загадок последних 30 лет.
Значительный вклад в изучение механизмов формирования пространственной структуры внесли исследования на модельных системах с денатурированными белками. Начиная с классических исследований Анфинсена (лауреата Нобелевской премии 1972 г. по химии) по ренатурации рибонуклеазы стало очевидным, что информация о пространственной структуре белка заложена в особенностях первичной структуры. Как оказалось, значительная часть белков, содержащих менее 150 аминокислот, может легко восстанавливать свою пространственную структуру после удаления агентов, вызвавших их денатурацию. Поэтому иногда говорят, что информация о пространственной структуре белка является второй частью генетического кода!
Модельные исследования показали, что сворачивание белка происходит не случайно. Оно проходит через кинетически предпочтительные стадии, определяемые особенностями первичной структуры. У одних белков это проявляется в форме образования спиральных участков уже во время синтеза на рибосоме, у других — в форме объединения гидрофобных радикалов аминокислот и т.д. При этом формируется некое переходное состояние структуры белковой молекулы (их может быть несколько), из которого белок затем быстро переходит в нативную конформацию (рис. 1, б). Переход от исходной развернутой полипептидной цепи в нативное состояние можно изобразить в форме воронки (рис. 1, а)[1], расширенная часть которой демонстрирует существование множества возможных энергетических состояний, обеспечивающих взаимодействие отдельных участков исходной развернутой полипептидной цепи (верхняя часть воронки).
После первых шагов сворачивания число благоприятных энергетических состояний уменьшается, что значительно сокращает время, необходимое для достижения нативной конформации. (Цитата «для перебора всех возможных конформаций в поисках нативного состояния, отвечающего минимуму свободной энергии, потребовалось бы слишком много времени: биллион лет для молекулы из 100 аминокислот. На это обстоятельство впервые обратил внимание Левинталь (Levinthal, 1968), Поэтому, в аминокислотной последовательности запрограммирована не только структура нативного состояния макромолекулы белка, но и пут ь ее достижения»)
В ряде случаев формируется переходное состояние молекулы, которое не обладает достаточной энергией для перехода в нативное состояние. Молекула, попавшая в энергетическую «ловушку», для выхода из нее нуждается в дополнительных участниках. Это могут быть кофакторы, шапероны или ферменты. Энергетические «ловушки» могут быть обязательным этапом в формировании нативной структуры. Они являются следствием нарушения процесса сворачивания из-за дефектов аминокислотной последовательности (мутации) или влияния окружения.

Рис. 1. Воронка, отражающая теоретическое распределение энергии в процессе укладки полипептидной цепи:
Развернутая полипептидная цепь, которая начинает сворачиваться, располагается в верхней части воронки. По мере выбора устойчивых конформаций с минимальной свободной энергией число благоприятных энергетических состояний и, следовательно, устойчивых конформаций, постепенно уменьшается. Нужно отметить, что возможных благоприятных состояний и, следовательно, путей достижения конечного устойчивого состояния может быть несколько. На пути к конечному устойчивому состоянию молекула может приобретать промежуточные конформации, выход из которых требует дополнительного участия других молекул (энергетические «ловушки».) В частности, выходу из этих ловушек могут способствовать молекулярные шапероны. Шапероны также могут предупреждать вход молекул в такие «ловушки»
Молекулы, которые пребывают в переходном состоянии, склонны к образованию нерастворимых агрегатов. Это относится почти ко всем белкам, имеющим в своем составе более 150 аминокислот. Попытки восстановить их нативную структуру в модельных системах заканчивались, как правило, образованием осадка. In vivo существует опасность агрегации белков, находящихся в переходном состоянии, но это происходит редко благодаря участию шаперонов[2] (рис. 2).
Шапероны относятся к группе белков «теплового шока» (HSP; англ. — heat-shock proteins). Их открытие связано с исследованием поведения клеток при нагревании. Так, изменение температуры от 37 до 42 °С вызывает нарушение фолдинга многих белков. Тогда клетки синтезируют специальные белки, помогающие восстанавливать структуру неправильно уложенных в пространстве белков.

Рис. 2. Возможные этапы формирования нативной структуры функционально полноценного белка
Выделяют два типа шаперонов — hsp60 и hsp70. Различия в их действии показаны на рис. 3, и рис. 4. Учитывая важную роль гидрофобных взаимодействий в формировании структуры белковой молекулы, на путь образования агрегатов легко могут встать белки, синтезируемые в водном окружении и экспонирующие гидрофобные группы. Шапероны, связывая участки, богатые неполярными группами, предотвращают агрегацию и, используя энергию гидролиза АТФ, способствуют преодолению энергетических барьеров на пути формирования нативной структуры белковой молекулы (см. рис. 2, 3, 4).
Влияние шаперонов распространяется лишь на белки, которые непосредственно синтезируются на рибосомах и находятся на цитозольной (наружной) стороне внутриклеточных пузырьков.
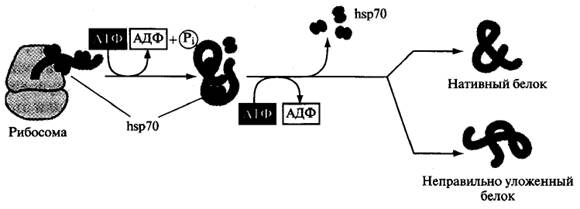
Рис. 3. Механизм действия шаперона hsp70

Рис. 4. Механизм действия шаперона ЬврбО
В поддержании нативной структуры белков внутри пузырьков клетки (эндоплазматический ретикулум, аппарат Гольджи, эндосомы) принимают участие другие механизмы, к изучению которых приступили лишь в последние годы. Наиболее незащищенными являются внеклеточные белки. Изменение их структуры ведет чаще всего к образованию агрегатов белков, нарушающих функции клеток. Это лежит в основе многих заболеваний.
Некоторая часть синтезируемых молекул не достигает стадии формирования нативной структуры. Для этого случая Природа предусмотрела механизм узнавания таких молекул и их удаления путем протеолиза. Важное место в этом механизме отводится убиквитину и протеасомному протеолизу. Наблюдения показывают, что более трети всех синтезированных белков подвергается протеолизу протеасомами. Этим Природа пытается максимально обезопасить себя от повреждающего действия агрегатов белков, возникающих из неправильно уложенных в пространстве и функционально бесполезных молекул. Наиболее известным признаком неправильно уложенной структуры является появление на поверхности белковой молекулы участков, богатых гидрофобными группами. Чаще всего такие участки становятся объектом узнавания шаперонами, задачей которых является предупреждение агрегации и облегчение формирования нативной структуры. Если это не удается, белок подвергается протеолизу.
Роль «черной метки», которая присоединяется к белку, подлежащему протеолизу, выполняет специфический белок — убиквитин, состоящий из 76 аминокислот. Распознавание белка и присоединение убиквитина катализируется специальной системой, состоящей из трех ферментов (Е1 Е2 и Е3). Она высоко специфична и избирательна за счет того, что построена по принципу иерархического усложнения[3].
Фермент Е, (в клетке он только один) активирует молекулу убиквитина и передает ее одному из ферментов семейства Е2 (их называют конъюгирующими). Затем в каскад реакций вступает третий участник Е3 — представитель семейства лигаз, «сшивающих» ферментов. Он принимает убиквитин от Е2, соединяется с белком-субстратом и ковалентно присоединяет к нему цепочку убиквитина.
Если Е, не имеет разновидностей, то семейство Е2 насчитывает 13 изоферментов в клетке дрожжей Saccharomyces cerevisiae, а у млекопитающих — гораздо больше. В семействе Е3 сейчас известно около 100 разных лигаз. Они-то и определяют высокую специфичность всей протеолитической системы.
Цепь реакций присоединения убиквитина показана на рис. 5.5. К белку- мишени может присоединяться целая цепь молекул убиквитина. Убиквитированные белки опознаются протеасомами и направляются внутрь, где протеазы «нарезают» их на пептиды, имеющие в своем составе 5—17 аминокислот. Образовавшись, они покидают протеасому и в цитозоле гидролизуются до аминокислот.
Протеасомы были обнаружены в конце 80-х годов XX столетия. Это оказался высокомолекулярный белковый комплекс, который работал в определенных условиях как несколько протеолитических ферментов. Он обнаруживался как у самых примитивных, так и у высших эукариот, в ядре и цитоплазме, что свидетельствовало о его важности для нормальной жизнедеятельности клетки. В 90-х годах выяснилось, что первоначально выделенный комплекс с молекулярной массой около 700 кДа и коэффициентом седиментации 20S в качестве протеолитического ядра входит в состав еще более сложной частицы. Первую стали называть 20S-протеасомой, вторую — 26S-протеасомой. Методами рентгеноструктурного анализа, электронной микроскопии и компьютерной томографии получили «портреты» обеих частиц. Выяснилось, что 208-протеасома — полый цилиндр длиной 15—17 нм и диаметром 11—12 нм, образованный четырьмя лежащими друг на друге кольцами. Каждое из них состоит из семи белковых субъединиц молекулярной массой 20—35 кДа), причем периферические кольца сформированы субъединицами α-типа, а два центральных — β-типа. Канал внутри цилиндра имеет три камеры: большую центральную и две меньшие, по краям. Протеолиз осуществляется в центральной камере. Роль α- и β-колец в работе протеасомы различна. Так, субъединицы α-кольца за счет своих гидрофобных участков закрывают отверстие в центральный канал и препятствуют случайному проникновению белков в протеолитическую камеру. Кроме того, эти же субъединицы отвечают за присоединение других высокомолекулярных комплексов, которые регулируют работу 20S-протеасом.

Рис. 5. Механизм присоединения «черной метки» (убиквитина) к белку, подлежащему протеолизу
Таким образом, клетка обладает рядом механизмов, позволяющих ей синтезировать белки и контролировать их качество (рис. 7).

Рис. 7. Судьба синтезированной полипептидной цепи
В ряде случаев этих механизмов бывает недостаточно, и молекула белка, ушедшая из-под контроля таких механизмов, может формировать нерастворимые агрегаты, нарушающие функцию клеток. Чаще это относится к внеклеточным белкам, на которые не распространяется действие приведенных механизмов. Тогда образующиеся агрегаты становятся причиной нарушения функций клеток. Это проявляется в форме различных заболеваний.
Самостоятельно проработать нарушения белков при следующих патологиях:
1. Серповидно-клеточная анемия.
2. Амилоидоз - группа заболеваний, вызванных образованием агрегатов белков в тканях.
3. Болезнь Паркинсона.
4. Прионные патологии.
5. Деменция (слабоумие) Альцгеймера.
ПРИ РАССМОТРЕНИИ ДАННЫХ ВОПРОСОВ НЕ НУЖНО ИЗУЧАТЬ СИМПТОМЫ, ПАТОГЕНЕЗ И ДР. А ТОЛЬКО ИСКЛЮЧИТЕЛЬНО НАРУШЕНИЯ БЕЛКОВ.
ГУГЛИТЕ НА ЗДОРОВЬЕ
[1] Число возможных конформационных состоянии полипептидной цепи уменьшается по мере приближения к нативному состоянию, поэтому такую энергетическую поверхность часто называют также «энергетической воронкой»
[2] от французского shaperon - няня
[3] Сигналами, которые определяют присоединение «черной метки» могут быть: конформация М-терминальной области пептида, в частности наличие «дестабилизирующей» К-концевой или другой свободной а-аминогруппы («1Ч-концевое правило») или специфически расположенный лизин в молекуле субстрата; определенные короткие участки в последовательности аминокислотных остатков (а не трехмерная структура целой молекулы белка); нарушение вторичной структуры белка (неправильное свертывание) поли- пептидной цепи; повреждение боковых цепей остатков аминокислот, в том числе их окисление (например, окисление остатков метионина); избыточное гликозилирование белков и пептидов.
 2020-05-25
2020-05-25 748
748






