В данной работе необходимо определить порядок реакции взаимодействия персульфата аммония с йодистым калием
(NH4)2S2O8 + 2KI = (NH4)2SO4 + I2 + K2SO4.
Выполняют три серии опытов, в каждой из которых проводят реакцию с двумя различными начальными концентрациями по заданию преподавателя (см. схему составления растворов).
1. Первую серию опытов проводят при комнатной температуре. В сухую пробирку наливают раствор (NH4)2S2O8, затем добавляют несколько капель крахмала. В присутствии свободного йода крахмал приобретает синее окрашивание. Затем в пробирку вливают раствор тиосульфата натрия (Na2S2O3), который должен связать по реакции
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
ровно половину выделяющегося свободного йода. Поэтому, когда количество выделившегося йода превысит количество тиосульфата, раствор начинает изменять цвет. Последним вводят раствор иодида калия KI и засекают время. Промежуток времени от момента ввода KI в реакционную смесь до момента изменения цвета раствора и есть половинное время реакции:
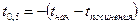 . .
|
2. Вторую серию опытов проводят аналогично первой, но в термостате с повышенной температурой. Для этого в две пробирки заливают заданные количества реагентов (кроме КI) и в две пробирки – раствор иодида калия. Пробирки выдерживают в термостате в течение 10 минут. Затем их содержимое сливают попарно, записывают время начала реакции и две пробирки с растворами вновь помещают в термостат, фиксируют момент изменения цвета раствора.
3. Третью серию опытов проводят с теми же концентрациями растворов при комнатной температуре, но в присутствии катализатора. Количество катализатора берут по заданию преподавателя. Катализатор прибавляют перед раствором KI. Половинное время реакции находят так же, как и в двух предыдущих сериях опытов.
4. Опытные данные заносят в таблицу. Для каждой серии опытов рассчитывают порядок реакции по уравнению (1.10).
5. Зная порядок реакции и половинное время реакции, рассчитываютконстантыскорости реакции для двух температур (1.8). По величинам констант скорости реакции при различныхтемпературах по уравнению (1.13) определяют величину энергии активации. Описывают влияние катализатора.
Рекомендуемый вид таблицы
| Серия опытов | Начальная концентра-ция | Время начала реакции, мин. | Время посинения, мин. | Половинное время
|
k |
n | |
| мин. | с | ||||||
| 1.(Т 1=) | с 0,1 = |
| |||||
| с 0,2 = | |||||||
| 2.(Т 2=) | с 0,1 = |
| |||||
| с 0,2 = | |||||||
| 3.с катали-затором | с 0,1 = |
| |||||
| с 0,2 = | |||||||
Схема составления растворов (*)
| Исходная концентрация с 0, моль/л | Объемы растворов, см3 | |||
| (NH4)2S2O8 | Na2S2O3 | H2O | KI | |
| 0,0225 | 3,0 | 3,0 | 8,0 | 6,0 |
| 0,0300 | 4,0 | 4,0 | 4,0 | 8,0 |
| 0,0375 | 5,0 | 5,0 | – | 10,0 |
(*) Внимание: в каждую пробирку с реакционной смесью обязательно добавляют 2 капли крахмала.
Работа № 2
 2020-06-12
2020-06-12 110
110

 ,
,






