Для определения порядка реакции необходимо иметь экспериментальные данные об изменении концентрации реагирующих веществ во времени при T = сonst.
Если мы имеем дело с реакцией первого порядка, то кинетическое уравнению имеет вид:
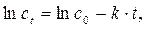 (2.1)
(2.1)
и в координатах 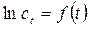 должна наблюдается прямолинейная зависимость, для которой
должна наблюдается прямолинейная зависимость, для которой
 (2.2)
(2.2)
Для реакции второго порядка кинетическое уравнение

или
 . (2.3)
. (2.3)
Мы имеем прямую в координатах  , для которой
, для которой
 (2.4)
(2.4)
В случае реакции третьего порядка кинетическое уравнение
 . (2.5)
. (2.5)
Мы имеем прямую в координатах  , для которой
, для которой
 (2.6)
(2.6)
Каждое кинетическое уравнение дает прямую линию только в соответствующих координатах. Если, например, опытные точки расположились на прямой линии в координатах 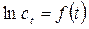 , а другие графические зависимости – кривые, то это указывает на то, что рассматриваемая реакция – реакция первого порядка. По угловому коэффициенту наклона этой прямой по отношению к оси t можно определить константу скорости реакции.
, а другие графические зависимости – кривые, то это указывает на то, что рассматриваемая реакция – реакция первого порядка. По угловому коэффициенту наклона этой прямой по отношению к оси t можно определить константу скорости реакции.
В данной работе необходимо графическим методом определить порядок реакции взаимодействия персульфата аммония с йодистым калием
(NH4)2S2O8 + 2KI = (NH4)2SO4 + I2 + K2SO4. (2.7)
При комнатной температуре определяют время, за которое концентрация (NH4)2S2O8 достигает сt = 0,85 c 0; 0,75 c 0; 0,65 c 0; 0,5 c 0; 0,25 c 0. По этим данным определяют кинетические константы ( и
и  ) графическим методом. Действительно, если взять 0,5 моль Na2S2O3 на каждый моль (NH4)2S2O8, то по реакции
) графическим методом. Действительно, если взять 0,5 моль Na2S2O3 на каждый моль (NH4)2S2O8, то по реакции
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
в соединение свяжется 0,25 моль йода от всего количества, которое образуется по реакции (2.7), и в присутствии крахмала раствор посинеет при сt = 0,75 c 0.
При добавлении 1,5 моль Na2S2O3 на каждый моль (NH4)2S2O8 концентрация за время от начала реакции до посинения раствора изменится от начальной до сt = 0,25 c 0.
Таким образом, добавляя к реагентам Na2S2O3 в различной пропорции, фиксируют время, при котором концентрация (NH4)2S2O8 достигает заданной величины. Графическая обработка экспериментальных данных позволит определить порядок реакции и константу скорости реакции.
 2020-06-12
2020-06-12 86
86








