В сухую пробирку наливают последовательно (см. схему составления растворов) раствор (NH4)2S2O8, затем добавляют несколько капель крахмала (индикатор), Na2S2O3 и KI. Раствор йодистого калия приливают последним и встряхивают пробирку. Момент после приливания йодистого калия в реакционную смесь и быстрого встряхивания, считают за начало реакции. Промежуток времени от начала вливания йодистого калия в реакционную смесь до момента посинения раствора и есть время изменения концентрации (NH4)2S2O8 от начальной с 0 до заданной величины сt.
Время от добавления KI до момента посинения раствора в пробирке и соответствующие концентрации сt заносят в таблицу.
Рекомендуемый вид таблицы
начальная концентрация c 0 =
| Номер пробирки | Концентрация сt, моль/л | Время t, мин |
| 1 | сt = 0,85∙ c 0 = | |
| 2 | сt = 0,75∙ c 0 = | |
| 3 | сt = 0,65∙ c 0 = | |
| 4 | сt = 0,5∙ c 0 = | |
| 5 | сt = 0,25∙ c 0 = |
Определяют порядок реакции и константу скорости 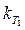 графическим методом.
графическим методом.
Для сt = 0,5 c 0 параллельно проводят еще одно определение времени реакции, поместив пробирку в термостат при повышенной температуре (по заданию преподавателя). Величину 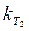 рассчитывают по половинному времени реакции
рассчитывают по половинному времени реакции 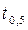 .
.
Рассчитывают энергию активации по уравнению (1.13) (см. работу №1).
Схема составления растворов (*)
| Номер пробирки | Концентрация сt, моль/л | Объемы растворов, см3 | |||
| (NH4)2S2O8 | Na2S2O3 | H2O | KI | ||
| 1 | сt = 0,85 c 0 | 5,0 | 1,5 | 3,5 | 10,0 |
| 2 | сt = 0,75 c 0 | 5,0 | 2,5 | 2,5 | 10,0 |
| 3 | сt = 0,65 c 0 | 5,0 | 3,5 | 1,5 | 10,0 |
| 4 | сt = 0,5 c 0 | 5,0 | 5,0 | – | 10,0 |
| 5 | сt = 0,25 c 0 | 4,0 | 6,0 | – | 8,0 |
(*) Внимание: в каждую пробирку с реакционной смесью обязательно добавляют 2 капли крахмала.
Работа № 3
Изучение кинетики реакции разложения мочевины
В водных растворах
Цель работы
Определить величину константы скорости и энергию активации реакции разложения мочевины в водном растворе.
Вопросы коллоквиума
Понятие скорости химической реакции. Средняя и истинная скорость реакции, константа скорости. Зависимость скорости химической реакции от концентрации раствора.
Классификация химических реакций по молекулярности и порядку.
Дифференциальные и интегральные кинетические уравнения формально простых гомогенных реакций.
Способы определения порядка реакций.
Зависимость скорости реакций от температуры. Температурный коэффициент Вант-Гоффа.
Уравнение Аррениуса. Энергия активации: понятие и методы определения.
Основные принципы катализа.
Теория активных соударений. Основные положения.
Применение теории активных соударений для описания кинетики элементарных реакций.
Приборы и реактивы
6.Учебно – лабораторный комплекс «Химия» в комплектации:
– центральный контроллер;
– модуль «Электрохимия» в комплекте с электродами для измерения электропроводности;
– модуль «Термостат» в комплекте со стаканчиком (на 150 см3), мешалкой и датчиком температуры.
7.Мочевина.
8.Дистиллированная вода.
 2020-06-12
2020-06-12 115
115








