1. Дайте определение константы диссоциации электролита. В чем заключается ее физический смысл? Обоснуйте влияние различных факторов на величину константы диссоциации.
2. Пользуясь законом разведения, рассчитайте степень диссоциации 0,01 М раствора HF, если константа диссоциации  = 10-2.
= 10-2.
3. Дайте определение рН раствора и рассчитайте, чему равен рН 0,001 н раствора КОН (α = 1).
4. Какие химические процессы подразумевают, применяя термин «гидролиз солей»? Какие соли дают при гидролизе кислую, а какие щелочную среду?
5. Напишите в ионной и молекулярной форме уравнения реакций гидролиза раствора соли Na2CO3.
Работа № 7. Буферные растворы
Цель работы − изучение равновесия в буферных растворах – физико-химических системах с постоянным значением кислотности среды − и определение их свойств.
Оборудование
1. pН-метр (рН-340) с датчиком.
2. Пять стеклянных колб.
3. Штатив с измерительными бюретками.
4. Мерные цилиндры.
Последовательность выполнения работы
Опыт 1
I. Приготовить пять буферных растворов, смешав О,1 н раствор уксусной кислоты СН3СООН и О,1 н раствор ацетата натрия СН3СООNa в соотношениях, указанных в таблице:
| Компоненты буферного раствора и рН | Номер колбы | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Кислота, мл | 27 | 24 | 15 | 9 | 4,5 |
| Соль, мл | 3 | 6 | 15 | 21 | 25,5 |
| рН, опытное | |||||
| рН, вычисленное | |||||
2. Измерить рН буферных растворов на рН-метре (описание прилагается к прибору) и результаты записать в таблицу.
3. По формуле (2.34) рассчитать значения рН для приготовленных буферных растворов, записать в таблицу, сравнить с опытными значениями.
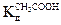 = 1,8 10-5.
= 1,8 10-5.
4. Построить график, отложив на оси абсцисс отношение объема соли к объему кислоты, а на оси ординат − значения рН.
Опыт 2.
 2020-06-08
2020-06-08 161
161








