1. Объясните «ход» вольт-амперной кривой.
2. Объясните механизм электрохимического полирования.
3. Какие дефекты могут возникнуть при электрополировании и в чем причина их возникновения?
4. Какие процессы протекают на аноде и катоде при полировании алюминия, меди, никеля и железа в кислых растворах?
Работа № 17. Определение скорости коррозии металла газометрическим методом
Цель работы – изучение механизма протекания электрохимической коррозии и определение коррозионной стойкости:
а) железа в слабокислой среде; б) алюминия в щелочной среде.
Оборудование
1. Специальная бюретка (см. рис. 6.6) с отводом к водоструйному насосу и расширенной нижней частью, в которой находится стеклянный крючок для подвешивания образца исследуемого металла.
2. Стакан с раствором серной кислоты H2SO4 или щелочи NaOH.
3. Металлическая пластинка (Fe или Al).
Последовательность выполнения работы
1. Измерить с двух сторон с помощью линейки площадь металлической пластинки.
2. Зачистить пластинку наждачной бумагой, промыть проточной водой и просушить фильтровальной бумагой.
3. Подвесить образец под колпак бюретки на крючок и опустить расширенную часть бюретки с подвешенным образцом в стакан с раствором кислоты (щелочи) при открытом верхнем кране бюретки.
4. Включить водоструйный насос (в присутствии лаборанта!), отвернув водопроводный кран. Когда раствор электролита поднимется в бюретке до верхних делений, закрыть кран бюретки и выключить водоструйный насос. Отметить первоначальный уровень жидкости в бюретке.
5. В течение 100 мин через каждые 20 мин. отмечать положение уровня мениска жидкости. Полученные данные занести в таблицу.
6. По окончании замеров открыть кран бюретки, извлечь образец, промыть водой и удалить с него остатки воды фильтровальной бумагой.
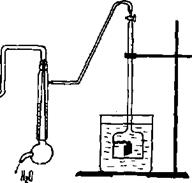
Рис. 6.6. Установка для определения скорости коррозии металла
 2020-06-08
2020-06-08 430
430








