Формирование постзиготической изоляции – своего рода точка невозвращения, после которой у двух популяций остается мало шансов слиться обратно в один вид. Многочисленные факты говорят о том, что постзиготическая изоляция возникает автоматически, сама собой, без помощи какого‑либо «отбора на несовместимость» или других специальных механизмов. Единственное, что для этого нужно, – это фактическая разобщенность двух популяций (отсутствие генетического обмена – неважно, по какой причине) и время. Причем времени может потребоваться много: до 10 млн лет и даже больше. Ну а если на популяции действует интенсивный разнонаправленный отбор, постзиготическая изоляция может развиться очень быстро, всего за несколько сотен поколений (на это указывают результаты экспериментов, с которыми мы вскоре познакомимся).
В конце 1930‑х – начале 1940‑х годов прошлого века Феодосий Добжанский и Герман Мёллер предложили простую модель, согласно которой постзиготическая несовместимость разобщенных популяций развивается как неизбежный побочный эффект их разобщенности. Допустим, в исходной популяции, еще до разделения, все особи имели генотип A1B1C1D1 (предположим для простоты, что организмы гаплоидные). Но вот популяция по какой‑то причине разделилась – например, несколько особей занесло бурей на необитаемый остров. После этого в каждой из двух популяций, материковой и островной, будут независимо закрепляться разные мутации – неважно, под действием отбора или дрейфа. Например, в островной популяции закрепится мутация в локусе A. Теперь генотип у обитателей острова будет A2B1C1D1. Может ли это привести к постзиготической несовместимости с материковой популяцией, где сохранился исходный генотип? Вряд ли, потому что ген А2 вполне совместим с генами B1, C1 и D1 (иначе он бы не смог закрепиться в островной популяции). Но вот по прошествии какого‑то времени в материковой популяции закрепилась другая мутация, например в локусе B. Теперь генотип материковых особей – A1B2C1D1. Ген В2 совместим с A1, C1 и D1: это было «проверено» отбором, который в противном случае отбраковал бы ген B2 и не дал ему закрепиться в материковой популяции. Однако ген B2 не проверялся отбором на совместимость с геном A2, который закрепился на острове. Следовательно, с некоторой вероятностью эти гены могут оказаться несовместимыми.
Очевидно, что вероятность появления пары несовместимых генов в двух популяциях будет расти пропорционально квадрату числа различающихся генов (т. е. квадрату «генетического расстояния» между популяциями). Например, если в каждой популяции закрепилось по одной мутации, как в нашем примере, то существует только одна пара потенциально несовместимых (не проверявшихся отбором на совместимость) генов: А2 и B2. Если закрепилось по две мутации (например, в островной популяции генотип стал A2B1C2D1, в материковой A1B2C1D2), то таких не проверенных отбором пар будет уже четыре: конфликт может возникнуть между A2 и B2, A2 и D2, C2 и B2, C2 и D2. Если в каждой популяции закрепилось по три мутации (все в разных локусах), число потенциально несовместимых пар будет равно девяти, и т. д.
Таким образом, модель Добжанского – Мёллера предсказывает, что число генов, ответственных за генетическую несовместимость, должно расти с ускорением, как снежный ком. Если предположить, что различия накапливаются с постоянной скоростью (т. е. исходить из допущения о равномерном ходе молекулярных часов), то число «генов несовместимости» должно быть пропорционально квадрату времени, прошедшего с момента разделения популяций.
Модель предполагает, что главную роль в формировании постзиготической изоляции играют попарные антагонистические взаимодействия («антагонистический эпистаз») между разными локусами. Если учитывать возможность конфликтов не только между двумя, но и между тремя и более локусами, то картина существенно усложнится.
В течение 70 с лишним лет, прошедших с момента появления этой модели, в ее работоспособности мало кто сомневался. Ее преподавали в университетах, а генетики, опираясь на нее, занимались поиском конкретных «генов несовместимости», порой весьма успешно. Но вот проверить ее напрямую не удавалось. Для этого нужно сравнить число генетических различий с числом «генов несовместимости» в нескольких парах родственных видов, различающихся по времени своего расхождения. Главная проблема в том, как подсчитать «гены несовместимости».
Лишь в 2010 году сразу двум научным коллективам одновременно удалось преодолеть эту трудность. Первая работа выполнена сотрудниками Чикагского университета на дрозофилах (Matute et al., 2010). Среди ее авторов – Джерри Койн, написавший замечательную научно‑популярную книгу Why evolution is true (Coyne, 2009) о доказательствах эволюции.
Ученые воспользовались тем обстоятельством, что некоторые виды дрозофил, хотя и разошлись давно, все еще сохранили способность к гибридизации. Авторы скрещивали самок Drosophila melanogaster с самцами двух других видов: D. simulans и D. santomea. Эволюционные пути видов melanogaster и simulans разошлись 5,4 млн лет назад, melanogaster и santomea – примерно 12,8 млн лет назад. Таким образом, время независимого существования в двух парах видов различается в 2,4 раза, и количество генетических различий тоже (собственно, по последнему и вычислили первое!). Если гипотеза Добжанского – Мёллера верна, число «генов несовместимости» в паре melanogaster – santomea должно быть примерно в 2,42 = 5,76 раза больше, чем в паре melanogaster – simulans.
Чтобы подсчитать «гены несовместимости» в каждой паре, авторы использовали большую, включающую сотни линий, коллекцию дрозофил D. melanogaster с различными делециями – выпадениями небольших участков генома. У мух из этих линий делеции поддерживаются в гетерозиготном состоянии. То есть у каждой мухи в одной хромосоме отсутствует какой‑то кусочек, но в другой, парной хромосоме этот кусочек имеется. При этом вторая, целая хромосома, во‑первых, «помечена» какой‑нибудь доминантной мутацией (чтобы сразу было видно, кому из потомства она досталась), во‑вторых, она неспособна рекомбинировать – обмениваться участками с парной хромосомой во время мейоза. Половина половых клеток такой мухи получает целую хромосому с меткой, а другая половина – хромосому с недостающим фрагментом и без метки.
Делеции, имеющихся в разных линиях, в общей сложности покрывают почти весь геном. Авторы скрещивали самок из этих линий (напомним, все они относятся к виду melanogaster) с самцами simulans и santomea. От таких межвидовых скрещиваний рождаются только самки. Потомство мужского пола погибает на ранних стадиях.
Здесь нужно сделать небольшое отступление, чтобы объяснить, почему так получается. Дело в том, что у самцов дрозофил, как и у людей, только одна X‑хромосома, а у самок – две. Поэтому гены, расположенные в X‑хромосоме, у самцов имеются в единственном экземпляре. Если хоть в одном из них имеется летальная мутация, самец обречен. У самки же есть вторая копия X‑хромосомы, в которой данный ген может быть нормальным. Нормальная копия гена «перекрывает» действие испорченной копии, и муха выживает.
Что же за летальные мутации сидят в генах Х‑хромосомы гибридных самцов? Это, очевидно, те самые «гены несовместимости», ради поиска которых все и было затеяно. Они конфликтуют с какими‑то другими генами в геноме того вида, которому не принадлежит данная X‑хромосома. Причем из того факта, что гибридные самки все‑таки выживают, можно сделать вывод, что все «гены несовместимости» в данной паре видов рецессивны. Допустим, если несовместимыми являются гены A2 и B2, причем ген B расположен на Х‑хромосоме, то гибридные самки с генотипом A1A2B1B2 будут жить, а самцы с генотипом A1A2B2 погибнут.
Итак, при скрещивании самки melanogaster с самцом simulans или santomea все потомство состоит из дочерей. Причем эти дочери будут двух типов. Первому типу достанется от матери, самки melanogaster, хромосома с отсутствующим кусочком. У таких гибридных мух соответствующий кусочек будет присутствовать в единственном экземпляре – в парной хромосоме, полученной от отца. Таким образом, отцовские гены, расположенные в этом кусочке, окажутся в «оголенном» (гемизиготном) состоянии – как если бы они сидели в X‑хромосоме самца. Если в этом фрагменте хромосомы имеется рецессивный «ген несовместимости», гибридные самки будут иметь пониженную жизнеспособность или вообще погибнут. Второй тип дочерей получит от матери melanogaster целую хромосому с меткой (по метке можно определить, к какому из двух типов относится данная гибридная самка). Все гены будут в двух экземплярах, и рецессивная несовместимость не проявится, т. е. все самки второго типа должны выжить.
Таким образом, по количественному соотношению гибридных дочерей первого и второго типа можно определить, содержится ли в данном кусочке хромосомы «ген несовместимости». Если обоих типов примерно поровну – значит, «гена несовместимости» там нет; если самок первого типа оказалось существенно меньше, чем второго, значит, он там есть.
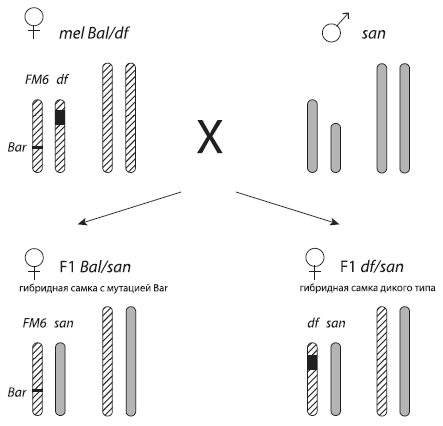
Схема экспериментов с дрозофилами. Хромосомы melanogaster (mel) показаны косой штриховкой, хромосомы santomea (san) – серым цветом. Скрещивается самка melanogaster с самцом santomea. Самая короткая – Y ‑хромосома, X ‑хромосома подлиннее. Черным показан отсутствующий участок хромосомы (в данном случае – X ‑хромосомы). Хромосома с отсутствующим участком помечена буквами df (от deficiency ). Вторая X ‑хромосома самки melanogaster – целая и помеченная доминантной мутацией Bar. В результате межвидового скрещивания получаются гибридные дочери двух типов: одни несут «целую» материнскую хромосому с меткой, другие получают от матери «урезанную» хромосому df. По выживаемости дочерей второго типа можно понять, есть ли в том кусочке ДНК, который был вырезан из хромосомы df, «ген несовместимости». Из Matute et al., 2010.
Таким непростым способом, скрещивая самок из пятисот линий melanogaster с различными делециями с самцами simulans и santomea, авторы просканировали 80 % мушиного генома в поисках «генов несовместимости». Им удалось выявить десять участков, содержащих «гены несовместимости», в паре melanogaster – simulans. В паре melanogaster – santomea таких участков оказалось 65, т. е. в 6,5 раза больше. Можно заметить, что эта величина близка к числу, предсказанному моделью Добжанского – Мёллера (5,74). При помощи сложных статистических методов авторы подтвердили, что их результаты гораздо лучше соответствуют предсказанию модели Добжанского – Мёллера об ускоряющемся, параболическом росте числа «генов несовместимости», чем альтернативной гипотезе о линейном росте. Так классическая модель наконец‑то получила красивое подтверждение.
Вторая работа была выполнена на растениях рода Solanum (паслен) сотрудниками Мемфисского и Индианского университетов (Moyle, Nakazato, 2010). Использовалось не три, как в первом исследовании, а четыре близких вида, различающихся по времени расхождения. Здесь тоже авторам понадобилась громадная коллекция подопытных линий, но на этот раз это были линии не мух, а томатов, и различались они не делециями, а небольшими фрагментами геномов диких видов рода Solanum, «встроенными» в геном томата. Получены эти линии были путем межвидовой гибридизации и последующих многократных «возвратных» скрещиваний с помидорами. Для каждой линии было известно, какой именно чужеродный фрагмент внедрился в ее геном. У каждой линии авторы измерили жизнеспособность семян и пыльцы. Если в данной линии оба показателя были в норме, из этого делался вывод, что фрагмент ДНК чужого вида, встроившийся в геном этой линии, не содержит «генов несовместимости». Таким способом удалось подсчитать, как и в первом исследовании, число участков генома, содержащих «гены несовместимости». Расчеты проводились раздельно для жизнеспособности семян и пыльцы.
Результаты по жизнеспособности семян полностью совпали с предсказанием модели Добжанского – Мёллера: число «генов несовместимости», влияющих на этот признак, растет пропорционально квадрату генетической дистанции. С пыльцой, правда, получился отрицательный результат: число «генов несовместимости», влияющих на этот признак, по мере увеличения генетической дистанции растет линейно, а не по параболе. Почему – пока не ясно. Авторы предполагают, что на стерильность пыльцы сильно влияют не попарные, а более сложные взаимодействия между многими локусами.
Так или иначе, обоим научным коллективам удалось получить эмпирические подтверждения адекватности модели Добжанского – Мёллера по крайней мере для некоторых ситуаций. Отрадно, что классики и на этот раз оказались недалеки от истины.
Вид из пробирки
Биологи давно мечтали воспроизвести процесс видообразования в лаборатории. Успехи в этой области достигнуты немалые. Все этапы и «слагаемые» этого процесса, как выяснилось, вполне воспроизводимы в эволюционном эксперименте. И если биологи то и дело не объявляют торжественно об искусственном создании настоящего нового вида, то только из‑за расплывчатости критериев вида, о которой говорилось выше. Причем среди применяемых критериев есть и такие, которые просто «по определению» не позволяют назвать новым видом что‑либо выведенное в лаборатории (или обособившееся недостаточно давно).
Хотя существует множество «хороших» (признаваемых большинством специалистов) видов, способных скрещиваться друг с другом и давать плодовитое гибридное потомство, главным критерием вида для организмов с половым размножением все‑таки считается репродуктивная изоляция. Именно на ней чаще всего и сосредоточиваются усилия биологов, ставящих эксперименты по искусственному видообразованию.
В одних экспериментах изучают зарождение презиготической изоляции. Для этого разные линии подопытных организмов подвергают разнонаправленному отбору (например, помещают в контрастные неблагоприятные условия и выращивают в течение многих поколений), а затем смотрят, не отбило ли у них охоту к перекрестному скрещиванию. Иногда охоту действительно отбивает, животные начинают избирательно скрещиваться со «своими», т. е. теми, чьи предки приспосабливались к таким же условиям (мы еще поговорим об этих опытах).
В других экспериментах изучают формирование постзиготической изоляции, т. е. пониженной приспособленности гибридов. Эти работы показали, что под действием разнонаправленного отбора такая изоляция может сформироваться гораздо быстрее, чем за счет одного лишь случайного накопления различий «по Добжанскому – Мёллеру». Ранее это было показано на тлях (Шапошников, 1965) и дрозофилах (Oliveira, Cordeiro, 1980), а недавно был проведен важный эксперимент на дрожжах (Dettman et al., 2007), с которого мы и начнем.
Дрожжи размножаются как половым путем, так и бесполым – почкованием. Биологи из Университета Торонто (Канада) получили из одной родительской диплоидной клетки 12 подопытных популяций. Изначально все они были генетически идентичны, но потом в результате мутаций и отбора могли накапливать различия. Популяции выращивали в течение 500 поколений в контрастных неблагоприятных условиях: шесть популяций при повышенной солености, шесть – в «голодной» среде с низким содержанием глюкозы. Контрольную (предковую) линию продолжали растить в нормальной среде.
После этого ученые проверили, произошла ли адаптация, т. е. стали ли подопытные популяции лучше приспособлены к своим средам по сравнению с предками. Приспособленность оценивали по скорости почкования клеток в условиях конкуренции с предковой линией. Оказалось, что адаптация произошла во всех 12 линиях, хотя величина приспособленности варьировала. К соленой среде дрожжи приспособились лучше, чем к голодной (вот уж поистине, от голодной диеты скорее умрешь, чем привыкнешь).
Теперь можно было приступить к главной части эксперимента – к выявлению постзиготической изоляции, если таковая возникла. Исследователи получили гибридное потомство, скрестив представителей «соленых» (С) и «голодных» (Г) линий. Кроме того, были получены гибриды подопытных линий с предками (П). Оказалось, что чистые линии С и Г приспособлены к своим средам значительно лучше, чем любые гибриды. Стало быть, частичная постзиготическая изоляция налицо.
Если приспособленность популяций к своим средам складывалась только за счет суммирования эффектов отдельных полезных мутаций, а эпистаза – влияния измененных генов друг на друга – не было, то приспособленность гибридов разного типа должна быть примерно одинаковой. Например, в соленой среде гибриды С/Г и С/П должны демонстрировать одинаковую приспособленность. Это, однако, оказалось не так. Гибриды С/П в соленой среде чувствовали себя лучше, чем С/Г (хотя и хуже, чем чистая линия С). То же самое справедливо и для «голодной» среды: здесь гибриды Г/П оказались более приспособленными, чем С/Г.
Этот результат можно объяснить двояко. Либо адаптации к одной из двух неблагоприятных сред сами по себе снижают приспособленность к альтернативной среде, либо имеет место эпистаз, т. е. гены, ответственные за адаптацию к разным средам, мешают друг другу работать. В первом случае дрожжи из линии С должны расти в голодной среде хуже, чем П, а в соленой среде П должны расти лучше, чем Г. Это не подтвердилось. Следовательно, главную роль в снижении приспособленности гибридов С/Г играет эпистаз.
Но это уже детали. Главный же результат в том, что показана возможность быстрого формирования постзиготической изоляции под действием разнонаправленного отбора. Как мы помним, появление такой изоляции – ключевой этап видообразования.
–––––
 2020-06-12
2020-06-12 87
87








