Половое размножение ускоряет адаптацию к меняющимся условиям – это и с теоретических позиций логично, и экспериментально подтверждается на реальных видах. Следующий естественный вопрос, который возникает у эволюциониста, – как адаптация половых и бесполых организмов выглядит на генетическом уровне? Почему половое размножение справляется с адаптацией лучше бесполого? До сих пор таких сравнений на геномном уровне не проводили, и не потому, что это праздный вопрос – как раз наоборот, крайне важно выяснить, в чем разница между эволюционными траекториями у половых и бесполых организмов. Но это технически трудная задача. Однако американские биологи придумали, как ее решить: они создали генно‑модифицированные штаммы дрожжей с половыми и бесполыми линиями, идеально подходящие именно для решения данной задачи. Оказалось, что при одинаковом темпе мутирования в половых популяциях за 1000 поколений закрепляется в 5 раз меньше мутаций, чем в бесполых популяциях такой же численности. Среди мутаций, закрепившихся в бесполых популяциях, встречаются вредные, тогда как в половых популяциях закрепляются только полезные мутации. Таким образом, половое размножение помогает отбору отделять полезные мутации от вредных, и за счет этого темпы адаптации увеличиваются. В бесполой популяции отбираться могут только целые геномы, поэтому каждая новая полезная мутация неразрывно связана со своим «генетическим фоном» и может распространяться только вместе с ним, а объединить в одном геноме две полезные мутации, возникшие у разных особей, невозможно. В половой популяции гены перемешиваются, что ведет к распространению целых ансамблей полезных мутаций, изначально появившихся у разных особей.


Согласно имеющимся теориям, половое размножение ускоряет адаптацию за счет того, что постоянная перетасовка и перемешивание индивидуальных геномов повышает эффективность закрепления отбором полезных мутаций и отбраковки вредных. Например, если полезная мутация возникла в геноме особи, у которой в другом гене есть вредная мутация, то в ходе полового размножения часть потомков унаследуют только полезную мутацию. Они‑то и будут поддержаны отбором. А при бесполом (клональном) размножении отбору приходится работать с целыми геномами. Поэтому полезная мутация может закрепиться лишь вместе со всем своим «генетическим фоном», включая все вредные мутации, которые есть в данном геноме. Иными словами, в бесполой популяции многие вредные мутации должны закрепляться, распространяясь за счет полезных мутаций, находящихся в других местах того же генома. Это называют «генетическим автостопом» (см. Исследования № 1 и 3).
Кроме того, в бесполой популяции полезные мутации, возникшие в разных генах у разных особей, не могут объединиться. Вместо этого их носители начинают конкурировать и вытеснять друг друга, что ведет к безвозвратной потере большинства полезных мутаций, возникающих в популяции. Это называют конкуренцией клонов, или клональной интерференцией (см. Исследование № 4).
Все это очень логично, но для полной уверенности не хватает прямых молекулярно‑генетических данных об эволюционных изменениях в половых и бесполых популяциях. Чтобы их получить, нужно, во‑первых, создать «правильные» подопытные популяции, не отличающиеся друг от друга ничем, кроме наличия или отсутствия полового размножения, а во‑вторых – проследить за изменениями их геномов в ходе эволюции.
Именно это и сделали недавно биологи из Гарвардского университета (США). Они провели эволюционный эксперимент на специально созданных для этой цели штаммах пекарских дрожжей, Saccharomyces cerevisiae (McDonald et al., 2016). В эксперименте участвовало 18 популяций: 12 бесполых, размножавшихся только почкованием, и 6 половых, которые тоже бóльшую часть времени размножались почкованием, но после каждых 90 бесполых поколений их заставляли спариваться и производить потомство половым путем. Все популяции были помещены в одинаковые условия, к которым они приспосабливались в ходе эксперимента, продолжавшегося 100 дней (примерно 1000 поколений).
Жизненный цикл дрожжей изображен на рис. 7.1. Гаплоидные клетки делятся на два пола: a и α. Они могут размножаться почкованием, а могут слиться и превратиться в диплоидную клетку. Диплоидные дрожжи тоже могут размножаться почкованием, а могут в результате мейоза превратиться в четыре гаплоидные споры, две из которых будут принадлежать к полу a, а две – к α.
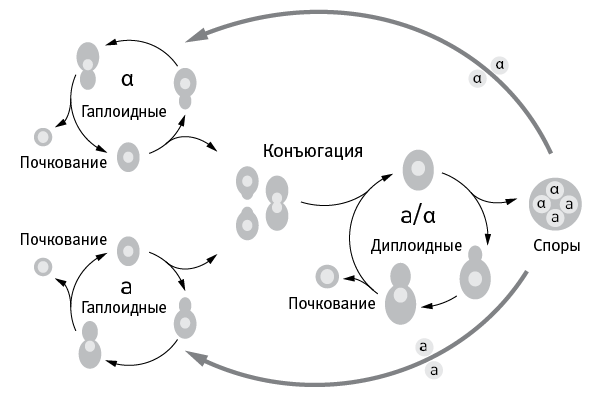
рис. 7.1. Жизненный цикл пекарских дрожжей (Saccharomyces cerevisiae).
В ходе эксперимента клетки бесполых популяций всегда находились в гаплоидной фазе и размножались исключительно почкованием. Чтобы они не спаривались, каждая популяция состояла из клеток только одного пола (шесть популяций a и шесть α).
Каждая половая популяция состояла из двух разнополых половинок, которые содержались раздельно в течение 90 поколений, а затем смешивались и помещались в условия, стимулирующие половой процесс. После этого отбирались диплоидные клетки, возникшие в результате спаривания, и помещались в условия, способствующие образованию спор. Затем отбраковывались диплоидные клетки, не захотевшие превращаться в споры, а гаплоидные клетки, полученные из спор, разделялись по половому признаку и снова содержались раздельно в течение следующих 90 поколений.
Чтобы провести все эти манипуляции, нужно иметь возможность быстро и эффективно отделять диплоидные клетки от гаплоидных, а также пол a от α. Для этого в геномы дрожжей были внесены изменения. В частности, были добавлены гены устойчивости к двум антибиотикам, причем так, чтобы клетки a оказались устойчивы только к первому антибиотику, клетки α – только ко второму, а диплоидные клетки – к обоим. Благодаря другим модификациям только гаплоидные клетки пола a умели синтезировать гистидин, лишь гаплоидные клетки пола α могли производить лейцин, а синтез урацила могли осуществлять гаплоидные клетки обоих полов, но не диплоидные. В результате исследователи получили возможность легко (в работе биологов‑экспериментаторов все относительно, в том числе и что значит «легко») отбирать нужные клетки и контролировать чистоту опыта, попеременно используя питательные среды, содержащие (или не содержащие) урацил, гистидин, лейцин и два антибиотика в разных комбинациях.
Условия содержания бесполых и половых популяций сделали настолько одинаковыми, насколько это было возможно. Численность всех популяций поддерживалась примерно на одном уровне (порядка 100 000 особей), они содержались в одинаковых емкостях, при одинаковой температуре и на одинаковой питательной среде.
По прошествии 1000 поколений была измерена приспособленность подопытных популяций. Для этого предковый штамм, помеченный флуоресцентной меткой, смешивали в равной пропорции с тестируемым штаммом и выращивали в течение 30 поколений в тех же условиях, в которых проходил основной эксперимент, а потом подсчитывали долю меченых клеток. Чем она меньше, тем выше приспособленность тестируемого штамма. Оказалось, что половые популяции адаптировались лучше бесполых: у первых приспособленность за 1000 поколений выросла на 10–15 %, у вторых – лишь на 5–10 %. Но это результат, можно сказать, тривиальный: способность полового размножения ускорять адаптацию уже не раз подтверждалась в экспериментах (о некоторых из них рассказано в нашей книге «Эволюция. Классические идеи в свете новых открытий»). Хотелось бы знать, что конкретно происходит с геномами половых и бесполых особей и каков генетический базис повышенного темпа адаптации половых популяций.
Чтобы разобраться в этом, исследователи использовали полногеномное секвенирование. Через каждые 90 поколений делались выборки из четырех половых и четырех бесполых популяций. Поскольку ДНК в каждой пробе содержала геномы множества клеток и анализировали их на мощном секвенаторе HiSeq 2500, Illumina, то в итоге получилась внушительная коллекция искомых мутаций, тех самых, что возникли в популяциях в ходе эволюционного эксперимента. Для каждой мутации имелась информация об изменении ее частоты со временем (примерно как в Исследовании № 3). Идентификация редких мутаций чревата ошибками, поэтому для надежности анализировались только те мутации, частота которых в данной популяции достигала 10 % хотя бы в два момента времени. Мутации, не получившие заметного распространения, игнорировались.
Все такие мутации, «выскакивавшие» по ходу экспериментальной адаптации, были сопоставлены с мутациями, которые к концу эксперимента зафиксировались, то есть имелись уже у всех клеток в данной популяции (рис. 7.2).
Оказалось, что во всех популяциях, как бесполых, так и половых, появилось примерно поровну новых мутаций (в среднем 44 на популяцию). Кроме того, среди зарегистрированных мутаций везде было примерно одинаковое соотношение несинонимичных (значимых, меняющих аминокислоту в белке), синонимичных (не меняющих белок) и межгенных (расположенных в некодирующих областях генома). Это значит, что процесс мутагенеза в двух вариантах опыта не различался.
Однако количество и состав зафиксировавшихся мутаций оказался совершенно разным в бесполых и половых популяциях. В первом случае зафиксировалось большинство (78 %) зарегистрированных мутаций, в том числе 79 % несинонимичных, 74 % синонимичных и 78 % межгенных. Иными словами, зафиксировались примерно равные доли мутаций всех трех типов. В половых популяциях все было по‑другому. Во‑первых, зафиксировалось гораздо меньше мутаций (16 % от общего числа зарегистрированных), во‑вторых, среди них оказались в основном значимые мутации (22 % от числа возникших), синонимичные не зафиксировались вовсе (0 %), а межгенных закрепилось лишь 11 % (рис. 7.2).
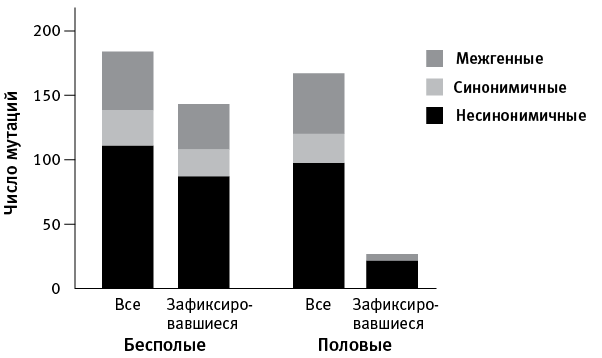
рис. 7.2. Соотношение всех появившихся мутаций и тех, которые к концу эксперимента зафиксировались, то есть встречались во всех клетках данной популяции. Суммированы данные по четырем бесполым и четырем половым популяциям. По рисунку из McDonald et al., 2016.
Этот результат отлично согласуется с идеей о том, что в половых популяциях фиксируются только полезные мутации (среди которых больше всего значимых, но есть и межгенные, находящиеся в регуляторных участках генома). Синонимичные мутации обычно нейтральны, и поэтому в половых популяциях они не фиксировались. В бесполых же популяциях вместе с немногочисленными полезными мутациями фиксировался весь их «генетический фон», включая вредные и нейтральные мутации, оказавшиеся в одном геноме с полезной (разумеется, при условии, что эффект полезной мутации перевешивал суммарные эффекты всех вредных мутаций, распространяющихся вместе с ней за счет генетического автостопа).
Здесь необходимо пояснить, что в долгосрочной перспективе в природных популяциях фиксируется больше всего нейтральных мутаций, в том числе синонимичных. Но это происходит не за счет отбора, а за счет генетического дрейфа (случайных колебаний частот аллелей). Однако в рамках данного эксперимента дрейфом можно пренебречь: слишком мало для него прошло времени и никаких кризисных снижений численности («бутылочных горлышек») не было. Для того чтобы в популяции с постоянной численностью 100 000 особей за счет дрейфа зафиксировалась новая нейтральная мутация, требуется время порядка сотен тысяч поколений. Но эксперимент продолжался всего 1000 поколений, поэтому в подопытных популяциях за счет дрейфа ничего зафиксироваться не могло. Те мутации, которые в них зафиксировались, сделали это наверняка под действием отбора, а не дрейфа.
Таким образом, полученный результат показывает, что половое размножение помогает отбору отделять полезные мутации от всех прочих и закреплять только их, тогда как в бесполых популяциях вместе с немногочисленными полезными мутациями «автостопом» фиксируется много всякого мусора.
Этот вывод подтвердился при анализе данных по изменению частоты встречаемости мутаций. В половых популяциях частоты разных мутаций менялись независимо друг от друга, а в бесполых большие группы функционально не связанных друг с другом мутаций меняли свою частоту синхронно. Первое соответствует индивидуальному действию отбора на отдельные гены, второе – клональной эволюции целых геномов. Кроме того, в бесполых популяциях некоторые группы мутаций сначала быстро наращивали свою частоту, а потом та снижалась вплоть до полного исчезновения. Это результат клональной интерференции, то есть вытеснения клонов с удачными мутациями другими клонами, обладающими еще более удачными мутациями. В половой популяции полезные мутации, возникшие у разных особей, объединялись и вместе закреплялись, но в бесполой популяции они могли только конкурировать и вытеснять друг друга.
Чтобы еще детальнее разобраться в том, как секс влияет на молекулярную эволюцию, ученые попытались напрямую оценить влияние отдельных мутаций на приспособленность дрожжей. Для этого они искусственно внедряли выявленные мутации в геном предкового штамма. Как и следовало ожидать, в каждой группе мутаций, зафиксировавшихся в бесполых популяциях (а при бесполом размножении мутации фиксируются именно группами), обнаружилась как минимум одна полезная мутация. Однако многие другие оказались нейтральными или вредными. Некоторые из них снижают приспособленность на 1–3 %. Ясно, что они могли зафиксироваться только за счет генетического автостопа. Предположение, согласно которому в бесполых популяциях из‑за автостопа могут закрепляться мутации со значительным вредным эффектом, высказывалось ранее, но экспериментально подтвердить его удалось впервые.
Среди мутаций, зафиксировавшихся в половых популяциях, вредных или нейтральных обнаружить не удалось – все они оказались полезными.
Это исследование относится к числу работ, подтверждающих и раскрывающих на более глубоком уровне старые, классические эволюционные идеи. В данном случае блестяще подтвердилась идея о том, что половое размножение ускоряет адаптацию, помогая отбору отделять полезные мутации от вредных. Половое размножение блокирует такие неблагоприятные для популяции процессы, как генетический автостоп, помогающий фиксироваться вредным мутациям, и клональная интерференция, обрекающая на гибель большинство вновь возникающих полезных мутаций (см. Исследование № 4).
Исследование № 8
 2020-06-12
2020-06-12 173
173








