Получение:
1) В промышленности не получают, а берут из природных источников, очищая физическими и химическими методами.
2) 2Н2 + O2 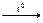 2Н2О (взрыв «гремучей смеси»)
3) СuO + Н2 2Н2О (взрыв «гремучей смеси»)
3) СuO + Н2  Cu + Н2О
*4) CН4 + 2O2 Cu + Н2О
*4) CН4 + 2O2 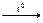 СO2↑+ 2Н2O
5) CaO + 2HCl → CaCl2 + Н2О
6) NaOH + HCl → NaCl + Н2О
7) 2NaOH + CO2 → Na2CO3 + Н2О СO2↑+ 2Н2O
5) CaO + 2HCl → CaCl2 + Н2О
6) NaOH + HCl → NaCl + Н2О
7) 2NaOH + CO2 → Na2CO3 + Н2О
|
| Физические свойства: При обычных условиях бесцветная жидкость без запаха и вкуса. При 0 ˚С превращается в лёд, а при 100 ˚С – в водяной пар. |
Химические свойства:
1) 2Н2О + 2Na → 2NaOH + H2↑ (также реагирует с K, Ca, Ba и др.)
2) Н2О + Zn 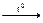 ZnO + H2↑ (также реагирует с Mg, Fe, Al и др.)
3) Н2О + CaO → Ca(OH)2 (также реагирует с Na2O, BaO и др.)
4) Н2О + SO3 → H2SO4 (также реагирует с SO2, CO2)
5) 3Н2О + P2O5 ZnO + H2↑ (также реагирует с Mg, Fe, Al и др.)
3) Н2О + CaO → Ca(OH)2 (также реагирует с Na2O, BaO и др.)
4) Н2О + SO3 → H2SO4 (также реагирует с SO2, CO2)
5) 3Н2О + P2O5 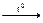 2H3РO4
*6) Н2О + Cl2 → НCl + HClO
*7) Н2О + C 2H3РO4
*6) Н2О + Cl2 → НCl + HClO
*7) Н2О + C 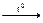 H2↑ + CO↑
**8) 2Н2О + 2F2 → 4HF↑ + O2↑
**9) 2Н2О + СаН2 → Са(ОН)2 + 2Н2↑
10) 2Н2O H2↑ + CO↑
**8) 2Н2О + 2F2 → 4HF↑ + O2↑
**9) 2Н2О + СаН2 → Са(ОН)2 + 2Н2↑
10) 2Н2O 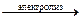 2Н2↑ + O2↑ 2Н2↑ + O2↑
|
| Применение: 1. Как химическое сырьё: для получения водорода, кислорода, кислот, щелочей, различных органических соединений. 2. Как растворитель в различных отраслях промышленности, в строительстве, на транспорте. 3. В паровых двигателях, системах охлаждения и отопления. 4. В быту, а также для орошения полей, садов и огородов. 5. Как катализатор. 6. Является важнейшей биологической жидкостью, необходимой для процессов жизнедеятельности живых организмов (пищеварения, кровообращения, размножения и т.д.) |
Основные сведения о воде
|
|

Сейчас читают про:
 2020-06-08
2020-06-08 86
86







