|
Физические свойства алканов
В обычных условиях первые четыре члена гомологического ряда алканов (С1—С4)—газы. Нормальные алканы от пентана до гептадекана (С5—С17) — жидкости, начиная с С18 и выше — твердые вещества. Из таблицы видно, что по мере увеличения числа атомов углерода в цепи, т. е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле, алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких, как бензол, тетрахлорметан и др.
Получение алканов
1. Промышленные способы:
- Фракционная перегонка нефти. Основным источником алканов служит нефть и природный газ.
- Гидрогенизация угля (сланцев, торфа, каменноугольных смол).
- Каталитическое гидрирование оксида углерода(II).
2. Лабораторные способы:
- Гидрирование ненасыщенных углеводородов ( при обычных температуре и давлении в присутствии катализаторов – никеля, палладия, платины):
CH3 -CH2 -CH = CH2 + H2 ® CH3 -CH2 -CH2-CH3
- Восстановление галогенопроизводных алканов ( в присутствии катализаторов):
CH3 -CH2 -CH2 - Cl + H2 ® CH3 -CH2 -CH3 + HCl
CH3 -CH2 -CH2 -I + HI ® CH3 -CH2 -CH3 + I2
- Реакция Вюрца.
CH3 - Br + 2Na + Br-CH3 ® CH3 -CH3 + 2NaBr
Химические свойства алканов
При обычных условияхалканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями — перманганатом калия КМnО4 и т. п.
Химическая устойчивостьалканов объясняется высокой прочностью σ -связей С—С и С—Н, а такжеих неполярностью. Неполярные связи С—С и С—Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов.
Для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Aлканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ.substitution radicalic).
Легче всего замещаются атомы водорода, находящиеся у третичных, затем у вторичных и первичных атомов углерода.

Примеры реакций замещения:
1. Галогенирование.
При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогенозамещенных алканов. Общая схема этой реакции показана на примере метана:
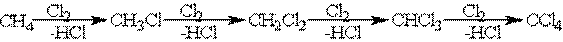
2. Нитрование (реакция Коновалова).
При действии разбавленной азотной кислоты в присутствии серной кислоты на алканы при 140 0С и небольшом давлении протекает радикальная реакция:

3. Изомеризация.
Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
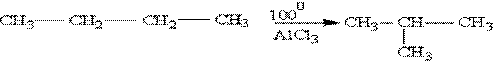
4. Окисление.
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены: метиловый спирт, формальдегид, муравьиная кислота:

Применение алканов.
Благодаря большой теплотворной способности метан в больших количествах расходуется в качестве топлива (в быту — бытовой газ и в промышленности). Широко применяются получаемые из него вещества: водород, ацетилен, сажа. Он служит исходным сырьем для получения формальдегида, метилового спирта, а также различных синтетических продуктов.
Большое промышленное значение имеет окисление высших предельных углеводородов — парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина).
Алканы также широко используются в органическом синтезе.
Тема: Циклоалканы
Общая формула циклоалканов СnH2n. Атомы углерода в циклоалканах, как и в алканах, находятся в sp3–гибридизованном состоянии и все их валентности полностью насыщены.
Простейший циклоалкан – циклопpопан С3Н6 – представляет собой плоский трехчленный карбоцикл.
Номенклатура циклоалканов
Согласно международной номенклатуре ИЮПАК в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки " цикло " (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце начинают от старшего радикала и ведут к ближайшему. Так, соединение:
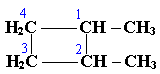
Следует назвать 1,2-диметилциклобутан.
Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле.
Изомерия циклоалканов:
1. Изомерия углеродного скелета боковых цепей.
2. Изомерия положения заместителей в кольце.
3. Межклассовая изомерия с алкенами.
Физические свойства циклоалканов
Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Химические свойства циклоалканов
1. Трех- и четырехчленные циклы (малые циклы) неустойчивы. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода. Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений: присоединяют галогены и галогеноводороды, подвергаются гидрированию:
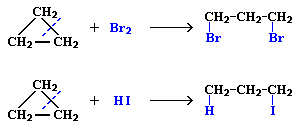
2. Для циклоалканов (С5 и выше) (большие циклы) вследствие их устойчивости характерны реакции, в которых сохраняется их циклическая структура, т.е. реакции замещения.
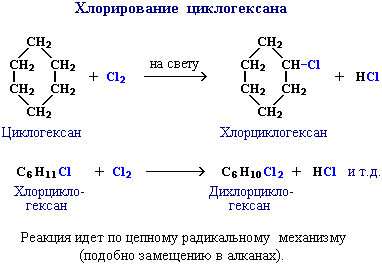
Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.
Получение циклоалканов
1. Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий - нафтены). При переработке нефти выделяют главным образом циклоалканы С5 - С7.
2. Действие активных металлов на дигалогензамещенные алканы (внутримолекулярная реакция Вюрца) приводит к образованию различных циклоалканов:

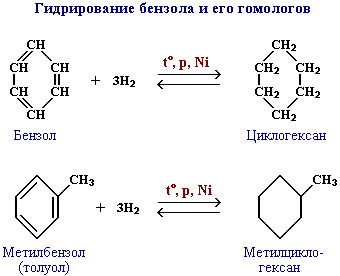
3. Гидрирование бензола и его гомологов, являющихся продуктами нефтепереработки.
 2020-06-08
2020-06-08 172
172








