АНАЛИТИЧЕСКАЯ ХИМИЯ
Ионные равновесия в растворах
Учебно-методическое пособие для студентов I курса
Петрозаводск
Издательство ПетрГУ
2010
Рассмотрено и рекомендовано к печати
на заседании редакционной комиссии
по отрасли науки и техники «Химия» 15 мая 2008 года
Печатается по решению редакционно-издательского совета
Петрозаводского государственного университета
Составители:
В. В. Вапиров, профессор;
Р. Д. Сальникова, доцент;
В. И. Беличенко, доцент;
Е. Я. Ханина, доцент;
Н. В. Вапирова, доцент
© Петрозаводский государственный университет, 2010
От составителей
В данном издании рассматриваются различные типы химических равновесий, применяемые в курсе аналитической химии.
Учебно-методическое пособие разделено на пять частей-модулей:
§ равновесия в водных растворах кислот и оснований;
§ буферные системы;
§ равновесия в растворах гидролизующихся солей;
§ равновесия в растворах малорастворимых соединений;
§ равновесия в растворах координационных соединений.
Каждый модуль содержит:
o краткое теоретическое пояснение к теме;
o разбор и решение типовых задач;
o контрольные вопросы;
o задания для самостоятельной работы студентов;
o справочные данные в виде таблиц.
Программа работы с модулем для студентов:
1. Ознакомиться с содержанием темы и ответить на предлагаемые контрольные вопросы.
2. Разобрать способы решения типовых задач, выделив в каждом основные этапы.
3. Проанализировать условие задачи для самостоятельного решения и выбрать необходимые справочные величины из таблиц.
4. Записать математические формулы, произвести в них возможные преобразования и выполнить расчеты.
Реализованный в данном пособии метод подхода должен активизировать самостоятельную деятельность студентов, развивать их логическое мышление и способствовать закреплению материала по курсу аналитической химии.
Расчет рН растворов кислот и оснований
Растворы сильных электролитов
Сильные кислоты и сильные основания в водных растворах практически полностью диссоциированы на ионы, но в результате межионных взаимодействий эффективная концентрация ионов меньше исходной концентрации электролита. Для точных химических расчетов вместо аналитической концентрации иона в растворе используют его эффективную концентрацию, которую называют активностью и обозначают через α. Связь между активностью иона (α) и его молярной концентрацией (С) выражается уравнением
α = fC,
где f — коэффициент активности,
С — молярная концентрация иона.
В очень разбавленных растворах сильных электролитов f ≈ 1 и α ≈ С.
Коэффициенты активности f рассчитывают по формуле
–lgf = 0,51Z2 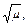
где Z — заряда иона,
µ — ионная сила раствора.
Ионная сила раствора µ определяется по формуле
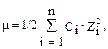
где Сi — молярная концентрация иона,
Z — заряд иона.
Обратите внимание, что если в условии задачи даны другие единицы выражения концентрации электролита, то их надо перевести в молярную концентрацию.
Коэффициент активности может быть определен и по таблице (Приложение, табл. 1).
 2020-06-08
2020-06-08 160
160







